一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:
CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法不正确的是( )
| A.检测时,电解质溶液中的H+向正极移动 |
| B.若溶液中有0.4 mol电子通过,则在标准状况下消耗4.48 L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH+O2==CH3COOH+H2O |
| D.正极上发生的反应为:O2+4e-+4H+=2H2O |
关于下列装置说法正确的是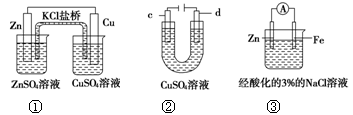
| A.装置①中,盐桥中的K+移向CuSO4溶液 |
| B.用装置②精炼粗铜,电解液浓度保持不变 |
| C.可以用装置②在铜上镀银,c极为银 |
| D.装置③中一段时间后会有Fe(OH)2生成 |
已知断裂1molH—H键所需要的能量为436 kJ,断裂1molN—H键所需要的能量为391 kJ。根据热化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则断裂1molN≡N键所需要的能量是
2NH3(g) ΔH=-92.4 kJ·mol-1,则断裂1molN≡N键所需要的能量是
| A.431 kJ | B.945.6 kJ | C.649 kJ | D.896 kJ |
下列燃烧反应的反应热是燃烧热的是
A.H2(g)+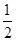 O2(g)═H2O(g)△H1 O2(g)═H2O(g)△H1 |
B.C(s)+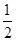 O2(g)═CO (g)△H2 O2(g)═CO (g)△H2 |
| C.S(s)+O2(g)═SO2(g)△H3 |
D.H2S(g)+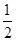 O2(g)═S(s)+H2O(l)△H4 O2(g)═S(s)+H2O(l)△H4 |
如图所示,△H1=-393.5kJ·mol-1,△H2=-395.4 kJ·mol-1,下列说法正确的是 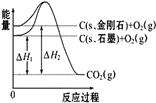
| A.C(s、石墨)═C(s、金刚石)△H="+1.9" kJ·mol-1 |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的能量比1 mol金刚石的总能量大 |
铅蓄电池的电池反应为 Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法错误的是
2PbSO4(s)+2H2O(l),下列说法错误的是
| A.放电时电解质溶液的H+浓度逐渐减小 |
| B.利用铅蓄电池电解饱和食盐水制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少0.10 mol |
| C.充电时阴极的电极反应为 PbSO4(s) + 2e-="Pb(s)" + SO42-(aq) |
| D.放电时负极材料质量减小 |