硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 。
(2)操作Ⅰ是 过滤洗涤。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的纯度是 。
某学生设计氨催化氧化实验(在催化剂存在时氨被氧气氧化生成NO和H2O),并将制得的NO进一步氧化为NO2,再用水吸收NO2并检验HNO3的生成。
可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO
可供选择的液体药品有:浓氨水、过氧化氢、浓盐酸、水
可供选择的仪器有:如图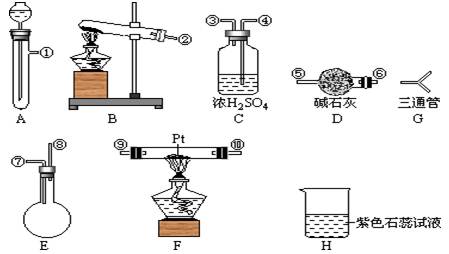
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择。设计实验时,A和B两个制气装置允许使用两次,其余装置只能使用一次。
(1)氨氧化制NO的化学反应为_______________,该反应应在装置____中进行。
(2)为快速制NH3和O2,制取NH3的装置最好选择_______,其化学反应方程式为______________;制取O2的装置最好选择_______,其化学反应方程式为_____________________。
(3)各仪器按气流方向连接的正确顺序为A、B→G→→ →C → E→[按装置先后顺序排列]
(4)如果实验前需收集一试管的氨气,如何采用一种简易方法检验试管中氨气是否集满(简述操作、现象和结论)
(5)装置C的作用是___________________。
(6)若经充分反应,从H中排出的气体对大气不会造成污染。装置E的使用方法是将E倒置,⑦为进气口,⑧为出气口,⑧插入H装置中.H中溶液变红,其原因是(用化学方程式表示)______________________。
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。用如图所示装置进行Mg和SO2反应的实验。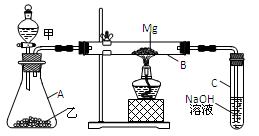
(1)选择制取SO2的合适试剂 。
①10%的H2SO4溶液②80%的H2SO4溶液
③Na2SO3固体④CaSO3固体
(2)写出装置乙和B中发生的主要反应的化学方程式:
;
。
装置C中NaOH溶液的作用是 。
(3)你认为该装置是否有不足之处? 。如果有,请说明 。
(共10分)某化学小组以环己醇制备环己烯(如下图),
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是_________;
②试管C置于冰水浴中的目的是____________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填字母)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_________口进入(填字母)。蒸馏时要加入生石灰,目的是___________________;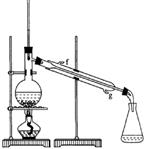
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母);
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________(填字母)。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
“化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生。下图所示就是一个“化学多米诺实验”,其中A~F装置中分别盛放的物质为:
| A.稀硫酸; | B.锌粒; |
| C.某溶液; | D.CaCO3固体;E、滴有紫色石蕊试液的蒸馏水;F、足量的澄清石灰水 |
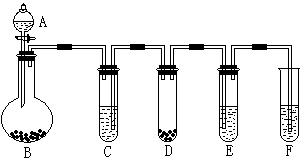
请回答下列问题:
⑴反应开始后,若E中出现红色,F中有白色沉淀生成,则C中的物质可能是
⑵写出装置D中反应的离子方程式:该反应的类型是:
装置F中反应的离子方程式:
⑶上图所示的B~F装置中,发生了氧化还原反应的是
(填装置编号)。请用单线桥表示出电子的转移
某实验需要80 mL、1 mol/L的Na2CO3溶液,现通过如下操作配制:
① 称量g Na2CO3固体放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以使用玻璃棒搅拌
②待溶液冷却到室温后,小心转入(填仪器名称)
③继续加蒸馏水至液面至刻度线1~2cm处,改用(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切
④将容量瓶塞紧,充分摇匀。
⑤用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都转入容量瓶,并轻轻摇匀
(1)操作步骤正确的顺序是(填序号)。
(2)使用容量瓶前必须进行的一项操作是
(3)若所配溶液的密度为1.06 g/mL,则该溶液的质量分数为。
(4)若取出20 mL配好Na2CO3的溶液,加蒸馏水稀释成c(Na+) ="0.1" mol/L的溶液,则稀释后溶液的体积为mL
(5)在配制Na2CO3溶液时,下列操作中的会导致结果偏低
①用拖盘天平称量时砝码放在左盘
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④未冷却到室温就转移到容量瓶中
⑤干净的容量瓶未经干燥就用于配制溶液