将适量的SO2通入Fe(NO3)3中,溶液逐渐由棕黄色变为浅绿色,但又立即变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的元素是
| A.S | B.Fe | C.Cl | D.N |
下列溶液中微粒的物质的量浓度关系一定正确的是
| A.25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)>c(NH4+) |
| B.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) +2c(OH-) = 2c(H+) + c(CH3COOH) |
| C.在NaHA溶液中(H2A为弱酸):c(Na+)>c(HA-)>c(OH-)>c(H+) |
| D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性: |
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
某同学按图所示的装置进行试验。A、B 为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析错误的是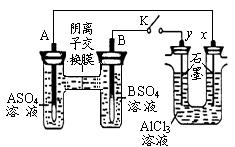
A.金属活动性A强于B
B.B 的电极反应:B-2e一= B2+
C.x电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色沉淀
下列离子或化学方程式与所述事实相符且正确的是
| A.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7: Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O  |
B.用K37ClO3与浓盐酸反应制氯气: K37ClO3 + 6HCl (浓) K37Cl + 3Cl2↑+ 3H2O |
| C.向硅酸钠溶液中通入过量的CO2: SiO32- + 2CO2 + 3H2O =H4SiO4↓+ 2HCO3— | |
| D.向AlCl3溶液中滴加过量的氨水:Al3++4OH-=AlO2—+ 2H2O |
下列装置或操作能达到实验目的的是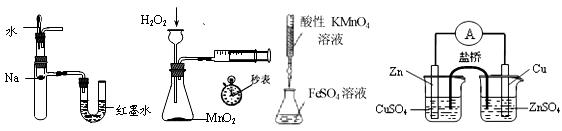
| A.验证反应的热效应 | B.定量测定化 | C.滴定FeSO4溶液 | D.构成铜锌原电池 |
学反应速率
A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,
B2+与C-具有相同的电子层结构,下列叙述一定不正确的是
A.离子半径A2-> C->B2+B.它们的原子序数A>B>C
C.它们的原子半径C>B>A D.原子最外层上的电子数C>A>B