利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是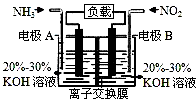
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.A电极上发生氧化反应,B为正极 |
| C.电极A极反应式为2NH3-6e-=N2+6H+ |
| D.当有2.24LNO2(标准状况)被处理时,转移电子为0.4mol |
设NA为阿伏伽德罗常数的数值,下列说法正确的是()
| A.10mL20mol/L浓硫酸与足量锌反应,转移电子数为0.2NA |
| B.0.1mol24Mg18O晶体中所含中子总数为2.0NA |
| C.在标准状况下,2.8gN2和2.24LCO所含电子数均为1.4NA |
| D.1L1mol/L的NaClO溶液中含有ClO-的数目为NA |
分子式为C5H12O的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)()
| A.15种 | B.16种 | C.17种 | D.18种 |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成氯化钠、次氯酸钠、氯酸钠共存体系。下列判断正确的是
| A.与氢氧化钠反应的氯气为0.16mol |
| B.n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为nmol,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
硫酸铜是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是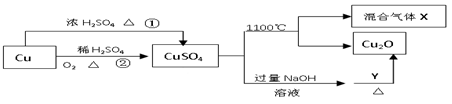
| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.硫酸铜在1100℃分解所得气体X可能是二氧化硫和三氧化硫的混合气体 |
| D.将硫酸铜溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |
向含SO32-、 Fe2+、 Br-、 I- 各0.1摩尔的溶液中通入标准状况下的氯气,通入氯气的体积和溶液中相关离子的物质的量关系图正确的是