设nA为阿伏伽德罗常数的数值,下列说法正确的是
| A.23g Na与足量H2O反应完全后可生成nA个H2分子 |
| B.1 mo1Cu和足量热浓硫酸反应可生成nA个SO3分子 |
| C.标准状况下,22.4L N2和H2混合气中含nA个原子 |
| D.3mo1单质Fe完全转变为Fe3O4,失去8nA个电子 |
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生 Cl2,下列关于混盐CaOCl2的有关判断不正确的是
| A.该混盐的水溶液呈碱性 |
| B.该混盐具有较强的氧化性 |
| C.该混盐中氯元素的化合价为零 |
| D.该混盐与硫酸反应产生71gCl2时转移1mol 电子 |
下列各组顺序的排列不正确的是
| A.离子半径:F->Mg2+>Al3+ | B.热稳定性:HCl>H2S>AsH3 |
| C.酸性:H3AlO3<H2CO3<H3PO4 | D.水溶性:SO2< H2S< NH3 |
已知C3N4 晶体具有比金刚石还大的硬度,且原子间均以单键结合。下列关于C3N4晶体的说法正确的是
| A.C3N4晶体是分子晶体 |
| B.C3N4晶体中微粒间通过离子键结合 |
| C.C3N4晶体中C-N键的键长比金刚石中C-C键的键长要长 |
| D.C3N4晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子 |
下列各图所示的实验原理、方法、装置和操作正确的是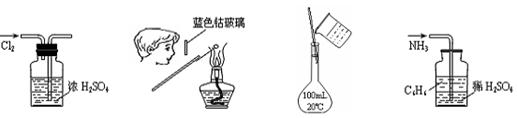
| A.干燥Cl2 | B.检验K+ | C.配制150 mL 0.10 mol·L-1盐酸 | D.吸收NH3 |
用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是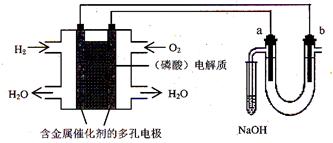
| A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH- |
| B.忽略能量损耗,当电池中消耗0.02g H2 时,a 极周围会产生0.02g H2 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl- |