铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO·Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是 。
(2)NaOH溶液可以除去铝表面的氧化膜,在处理过程中常会产生H2,产生H2的离子方程式是 。
(3)工业上以铝土矿(Al2O3·H2O)为原料生产铝,主要包括下列过程:
i.将粉粹、筛选后的铝土矿溶解在NaOH溶液中;
ii.加入过量的试剂A使所得溶液中析出Al(OH)3固体;
iii.使Al(OH)3脱水生成Al2O3;
iv.电解熔融Al2O3生成Al。
铝土矿粉粹的目的是 ,试剂A的化学式是 ,电解熔融Al2O3时,加入冰晶石,其作用是 。
(4)明矾化学式为KAl(SO4)2·12H2O,向明矾溶液中加入Ba(OH)2溶液,当溶液中的SO42-恰好沉淀时,铝元素的存在形式是 。
(5)美国普度大学研究开发出一种利用铝镓(化学式:AlGa)合金制取氢气的新工艺(如下图所示)。

i.写出常温下铝镓合金产生氢气的化学方程式 。
ii.下列有关该工艺的说法正确的是 。
| A.该过程中,能量的转化形式只有两种 |
| B.铝镓合金可以循环使用 |
| C.铝镓合金的熔点比金属铝低 |
| D.该工艺可利用太阳能分解水 |
(15分)A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
A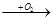 B
B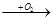 C
C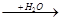 D
D
(1)若A、D的水溶液均能使湿润的蓝色石蕊试纸变红,则A、D分别为(填写化学式)。
A ,D。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红,则A为。写出A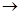 B转化的化学方程式:。
B转化的化学方程式:。
(3)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则A是,
B是,C是。C可作为呼吸面具的填充剂,C与二氧化碳发生反应的化学方程式为:。A跟水发生反应的化学方程式。
(4)若A为常见的非金属单质,则A有多种情况,请填写下表,并完成相应的化学反应方程式。(可以不填满,也可以补充)
| 编号 |
A |
· B—C化学方程式 |
| ① |
||
| ② |
||
| ③ |
(5分)有一瓶澄清的溶液,其中可能含有H+、NH4+、Mg2+、Ba2+、Al3+、I-、NO3-、CO32-、SO42-、AlO2-,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红 色。
色。
(3)另取出部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生。
(4)取出部分上述(3)的溶液加Na2CO3溶液后,有白色沉淀生成。
根据上述实验事实可以确定,该溶液中肯定存在的离子是 ,还不能确定是否存在
,还不能确定是否存在 的离子是
的离子是 。
。
. (10分)下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
请回答:
(1)反应①是(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
________(填写字母序号)。
| A.缩小反应容器的容积 |
| B.扩大反应容器的容积 |
| C.升高温度 |
| D.使用合适的催化剂 |
E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时__________________;t8时__________________。
②若t4时降压, t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时
间的关系线。
(14分)芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如下图所示:
(1)C中含氧官能团的名称是;B→A的反应类型是。
(2)H的结构简式是。
(3)写出下列化学方程式:
① D与银氨溶液反应___________;② E→I。
(4)有的同学认为B中可能没有氯原子,你是__________(填“同意”或“不同意”),你的理由_______________。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有________种,写出其中任意一种同分异构体的结构简式____________。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
(8分)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式______。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是______g,溶液中的c(SO42-)=______mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则X极是(正、负极),电极反应式。Y极的材料名称是,电极反应式。