将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g)+a Q(g)
2Z(g)+a Q(g)
达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述错误的是
| A.a的值为2 | B.平衡时X的浓度为0.2 mol/L |
| C.平衡时Y的转化率为60% | D.平衡时Z的体积百分含量为20% |
防治环境污染、改善生态环境已成为全人类的共识。
①下列各项中,完成空气质量报告时不需要监测的是(填字母)。
a.可吸入颗粒物的浓度 b.二氧化氮的浓度
c.二氧化碳的浓度
②下列做法中不利于改善环境质量的是(填字母)。
a.将废旧电池进行深埋处理 b.充分利用太阳能等清洁能源
c.给汽车加装尾气催化净化装置
③工业废水需处理达标后才能排放。轧钢厂排出的废水主要是含盐酸的酸性废水,处理此废水可采用的方法是(填字母)。
a.沉淀法 b.中和法 c.氧化还原法
下列实验或生产过程中发生的变化是物理变化的是( )
①在鸡蛋白溶液中加入(NH4)2SO4后形成沉淀;②用渗析的方法除去混在Fe(OH)3胶体中的FeCl3;③NO2经加压凝聚成无色的液体;④溴水滴入植物油中振荡褪色;⑤水泥、沙子和水混合后硬化;⑥照相底片感光
| A.①②③ | B.②④⑥ |
| C.①② | D.③⑤ |
已知在溶液中IO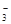 与I-发生反应5I-+IO
与I-发生反应5I-+IO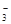 +6H+===3I2↓+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明食盐中存在IO
+6H+===3I2↓+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明食盐中存在IO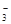 。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤蔗糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是( )
。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤蔗糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是( )
| A.①③ | B.③⑥ | C.②④⑥ | D.①②④⑤⑦ |
下列实验能达到预期目的的是
①用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子;②用溴水检验汽油中是否含有不饱和链烃;③用乙醇从碘水中萃取碘;④用盐析方法分离提纯蛋白质;⑤用加热方法提纯含有少量碳酸氢钠的碳酸钠固体;
⑥用氨水清洗试管壁附着的银镜
| A.②④⑤ | B.①③⑥ | C.①②④⑤ | D.②③④⑤⑥ |
下列说法错误的是( )
| A.酸雨是指PH<5.6雨 |
| B.在正常情况下人体血液PH为7.35~7.45 |
| C.有色水泥主要是因为水泥中含有CuCl2 |
| D.红色玻璃主要是因为玻璃中含有少量Cu2O |