从下列事实所列出的相应结论正确的是( )
| |
实验事实 |
结论 |
| ① |
铜生的锈是绿色的称为铜绿 |
铜绿是致密的氧化膜 |
| ② |
浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 |
都发生了氧化还原反应 |
| ③ |
少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 |
酸性:HCO3->Al(OH)3 |
| ④ |
某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味的气体,该溶液滴加CaCl2溶液,有白色沉淀现象 |
确定该溶液存在CO32- |
| ⑤ |
某无色溶液加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有NH4+ |
A.②③⑤ B.①②③ C.③④⑤ D.全部
X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大。X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,Z的单质具有半导体的特性,W原子的最外层电子数是其电子层数的2倍。下列说法错误的是
| A.X与氧元素形成的化合物中可能含有共价键 |
| B.第三周期元素的简单离子中Y离子的半径最小 |
| C.Z、W的氧化物均为酸性氧化物 |
| D.R元素含氧酸的酸性一定强于W |
下列实验设计或操作正确的是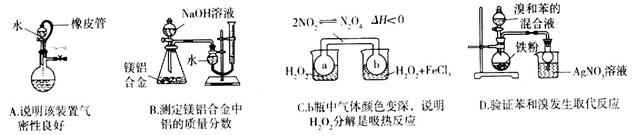
对下图两种化合物的结构或性质描述正确的是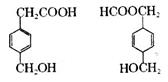
| A.互为同分异构体 |
| B.均能与Na反应且产物相同 |
| C.均可发生取代反应和加成反应 |
| D.分子中共平面的碳原子数相同 |
下列说法正确的是
| A.18gH218O含有l0NA个质子 |
| B.过量铁粉在氯气中燃烧生成FeCl2 |
| C.0.1mol·L-1NaAlO2溶液中可以大量存在:HCO3-、NH4+、SO42-、Fe3+ |
| D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明ksp(CuS)远小于Ksp(FeS) |
下表中对应关系正确的是