常温下,在下列指定条件的各溶液中,一定能大量共存的离子组是
| A.中性溶液中:K+、Fe3+、ClO-、SO42- |
| B.pH<7的溶液中:Na+、Ba2+、Br-、Cl- |
| C.加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- |
| D.c(H+)/c(OH-)=10-12的溶液中:K+、NH4+、HCO3-、NO3- |
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.若在原电池中进行,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.改变压强,平衡不发生移动,反应放出的热量不变 |
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-= PbSO4+2e-
正极:PbO2+4H++SO42-+2e-= PbSO4+2H2O
今若制得Cl2 0.10 mol,这时电池内消耗的H2SO4的物质的量至少是
| A.0.025 mol | B.0.050 mol | C.0.10 mol | D.0.20 mol |
向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是 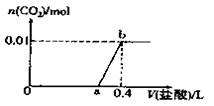
| A.在0-a范围内,只发生中和反应 |
| B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑ |
| C.a=0.3 |
| D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
X、Y、Z、W有如图所示的转化关系,则X、Y可能是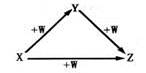
①C、CO②AlCl3Al(OH)3③N2、NO④S、SO2
A.②③B.①②C.③④D.①④
下表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是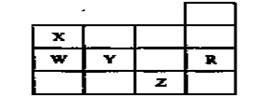
| A.常温常压下,五种元素的单质中有两种是气态 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物比X的氢化物稳定 |
| D.Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者 |