写出下列符号中“2”的含义
① H2O: ____________ ___② Ca2+ ___________ _______
科学探究是奇妙的过程。在一次实验中,小明不小心把硫酸铜溶液滴加到了盛有 5%H2O2的溶液的试管中,立即有大量的气泡产生。硫酸铜溶液中含有三种粒子(H20、SO2-、Cu2+),小明想知道硫酸铜溶液中的哪种粒子能使双氧水分解的速率加快。请你和小明一起通过下图所示的三个实验完成这次探究活动,并填写空白。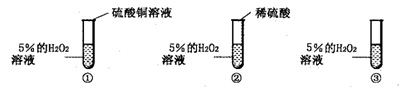
(1)你认为最不可能的是哪一种粒子,理由是____________________________。
(2)检验实验①产生的气体的方法是__________________________________。
(3)要证明另外两种粒子能否加快双氧水分解的速率,还需要进行实验②和③;
在实验②中加入稀硫酸后,无明显变化,证明_________不起催化作用;
在实验③中加入______后,会观察到大量的气泡,证明起催化作用的是_____。
(4)小明如果要确定硫酸铜是催化剂,还须通过实验确认它在化学反应前后_________。
根据所学知识并结合图11所示装置回答下列问题。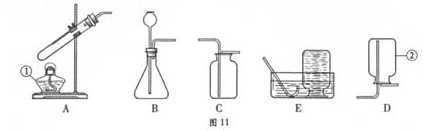
(1)图中标有①、②的仪器名称:①②
(2)用装置B制取一种气体的化学方程式为。
(3)用高锰酸钾制取氧气的化学方程式为,若选择A和C装置制取并收集氧气,则要对A装置进行的改进是,证明氧气已收集满的方法是。
(4)组装一套实验室制取并收集二氧化碳的装置,可选用图中的和。(填标号)检验二氧化碳的方法是。(用化学方程式表示)
小华同学做铁丝在氧气中燃烧的实验时,用了两种不同的方法点燃铁丝,进行了如下的实验。请分析回答: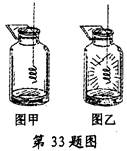
(1)把铁丝放在酒精灯外焰上加热,当铁丝发红时,把铁丝移人盛有足量氧气和少量水的集气瓶内,铁丝不能燃烧(如图甲所示),这是因为将发红的铁丝移至集气瓶内时,;
(2)改用火柴引燃铁丝,铁丝在盛有足量氧气和少量水的集气瓶内发生剧烈燃烧,火星四射,并生成一种黑色固体(如图乙所示)。请写出这种黑色固体的化学式。
请根据下列装置图,回答有关问题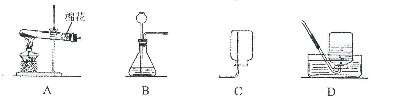
(1)写出实验室在B装置中用H2O2制取氧气的化学方程式:
。
(2)实验室收集氧气可用(填编号)装置,在收集过程中,当氧气充满集气瓶后,将导管从瓶口处移开,在桌上。
(3)用A装置制取氧气时,试管内的棉花没有发生燃烧,从根据燃烧的投机倒把分析 ,主要原因是。
氨气极易溶于水,常温常压下1体积水可溶解700体积的氨气,溶解后可与水反应生成一水合氨,溶液显碱性。氨气的密度比空气小。已知:
2NH4Cl(固体)+ Ca(OH)2(固体) 2NH3↑+ CaCl2+ 2H2O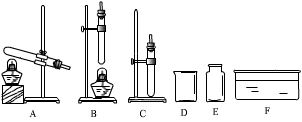
(l)如果制取并收集保存氨气,请从上图中选取装置和仪器(填序号)。
(2)氨气不能用排水法收集,原因是。