一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是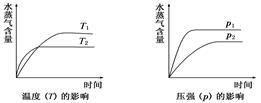
A.CO2(g)+2NH3(g)  CO(NH2)2(s)+H2O(g);ΔH<0 CO(NH2)2(s)+H2O(g);ΔH<0 |
B.CO2(g)+H2(g)  CO(g)+H2O(g);ΔH>0 CO(g)+H2O(g);ΔH>0 |
C.CH3CH2OH(g)  CH2==CH2(g)+H2O(g);ΔH>0 CH2==CH2(g)+H2O(g);ΔH>0 |
D.2C6H5CH2CH3(g)+O2(g)  2C6H5CH=CH2(g)+2H2O(g);ΔH<0 2C6H5CH=CH2(g)+2H2O(g);ΔH<0 |
在给定的四种溶液中,含有以下各种微粒,一定能大量共存的是 ( )
| A.由水电离的c(OH-)=1×10-12mol/L的溶液中:Ba2+、K+、Br-、SiO32- |
| B.常温下葡萄糖溶液中:SCN—、Cl-、K+、NH4+ |
| C.溴水中:Na+、CO32-、NH4+、SO42— |
| D.PH大于7的溶液: Na+、Ba2+、SO32-、ClO— |
近年来,科学家合成了一种稳定的氢铝化合物Al2H6。Al2H6的球棍模型如下图所示,它的熔点为150℃,可用作高能燃料或储氢材料。下列说法正确的是 ( )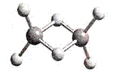
| A.Al2H6可以燃烧,产物为氧化铝和水 |
| B.1mol Al2H6中约含有4.8×1024个σ键 |
| C.60g Al2H6中含铝原子约为1.2×1023个 |
| D.Al2H6在固态时所形成的晶体是离子晶体 |
下列说法正确的是
| A.相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4C1、③CH3COONH4、④NH3·H2O,c(NH4+)由大到小的顺序是:①>②>③>④ |
| B.某溶液中由水电离出的c( H+)=1×l0-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C.常温下,向AgCl悬浊液中加入少量NaC1固体后振荡,c(Cl-)增大,Ksp(AgCl)增大 |
| D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-) +c(HR-)=c(Na+) |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是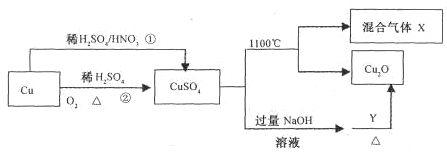
| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1 mol |
| D.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
一定温度下,将1 mol A和1 mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)  xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是
| A.反应方程式中的x=l |
| B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是移去少量物质D |
| D.t1~t3间该反应的平衡常数均为4 |