某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱(Na2CO3)和氯化铵(NH4Cl)。

已知盐的热分解温度:NH4HCO3 36℃;NaHCO3 270℃;NH4Cl 340℃;Na2CO3>850℃
请回答:
(1)从NaCl溶液到沉淀1的过程中,需蒸发浓缩。在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3固体之后,其原因是 。
(2)为提高NH4Cl产品的产率和纯度,需在滤液1中加入氨水,理由是 ;步骤X包括的操作有 。
(3)测定NH4Cl产品的纯度时,可采用的方法:在NH4Cl溶液中加入甲醛使之生成游离酸(4NH4Cl+6HCHO=(CH2)6N4+4HCl+6H2O),然后以酚酞为指示剂,用NaOH标准溶液(需用邻苯二甲酸氢钾基准物标定)进行滴定。
①下列有关说法正确的是
| A.为了减少滴定误差,滴定管、锥形瓶均须用待装液润洗 |
| B.标准NaOH溶液可以装入带有耐腐蚀旋塞的玻璃滴定管中 |
| C.开始滴定前,不需擦去滴定管尖悬挂的液滴 |
| D.三次平行测定时,每次需将滴定管中的液面调至“0”刻度或“0”刻度以下的附近位置 |
②若用来标定NaOH标准溶液的邻苯二甲酸氢钾基准物使用前未烘至恒重,则测得NH4Cl产品的含量比实际含量 (填“偏大”、“偏小”或“无影响”)。
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:


图Ⅰ图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是。
(2)工艺流程中“副产品”的化学式为。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价:(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为。
近年来,我国部分地区相继发现一些以发热伴血小板减少为主要表现的感染性疾病病例。氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2-氯苯甲醛为原料的合成路线如下:
(1)X的结构简式为 。
(2)分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,写出该反应的化学方程式 。
(3)C→D的反应类型是 反应,物质D有两种结构,但只有一种能合成具有药理作用的氯吡格雷。物质D有两种结构的原因是 。
(4)写出A能属于芳香族化合物的所有同分异构体的结构简式:
(5)已知:
写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选)。
的合成路线流程图(无机试剂任选)。
合成路线流程图示例如下: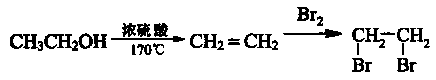
下表为长式周期表的一部分,其中的序号代表对应的元素。
(1)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为杂化, 键与
键与 键的个数比为。
键的个数比为。
(2)元素③、④、⑤、⑥的第一电离能由大到小的顺序为。其中⑥元素核外电子的电子排布图为。
(3)③元素形成的最高价氧化物所形成的晶胞边长为acm,则其晶胞密度为;
(4)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,还原产物没有气体,该反应的离子方程式为。
(5)元素③与⑤形成的原子个数比为1:1化合物能与⑩的单质形成形式为A(BC)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,其晶体类型,该配合物在一定条件下分解生成⑩的单质和③与⑤形成的原子个数比为1:1化合物,则在分解过程中破坏的化学键为,形成的化学键为。
(6)化学上有一种见解,认为同种元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,请用表中的元素举例说明(酸性由强到弱的顺序)。
氮化硅( Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
I.工业上有多种方法来制备氮化硅,常见的方法有:
方法一:直接氮化法:在1300℃-1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
。
方法二:化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HC1,与方法一相比,用此法制得的氮化硅纯度较高,其原因是.
方法三:Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体(填分子式)________;然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为。
II.工业上制取高纯硅和四氯化硅的生产流程如下:
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是(写名称)。
(2)写出焦炭与原料B中的主要成分反应的化学方程式:。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu(填“能”或“不能”),写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极:;阴极:。
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为。 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
| 起始浓度( mol/L) |
C(NH3) |
C(O2) |
C(NO) |
C(H2O) |
| 甲 |
1 |
2 |
0 |
0 |
| 乙 |
4 |
8 |
0 |
0 |
| 丙 |
0.2 |
x |
y |
z |
①恒温恒容下,平衡时NH3的转化率甲乙。(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=,y=,z= .
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g) N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_a2。
A.大于 B.小于 C.等于 D.以上都有可能
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是。
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式:。反应过程中,氧化剂和还原剂物质的量之比为。
(2)若反应中生成0.2mol HNO3,转移的电子数目为。