NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、
KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是
| A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1 |
| C.图中b、c两点对应的NaHSO3反应速率相等 |
| D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂 |
下列研究目的和示意图相符的是( )
| A |
B |
C |
D |
|
| 研 究 目 的 |
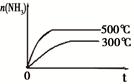
固定容积的密闭容器中,压强对反应: 2SO2(g)+O2(g) 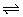 2SO3(g)的影响 2SO3(g)的影响 |
固定容积的密闭容器中,温度对反应: N2(g) +3H2(g) 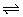 2NH3(g) ΔH< 0的影响 2NH3(g) ΔH< 0的影响 |
固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应: CO(g)+H2O(g) 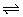 CO2(g)+H2(g)的影响 CO2(g)+H2(g)的影响 |
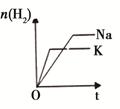
等质量Na、K 分别与足量水反应 |
| 示 意 图 |
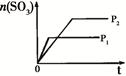 |
 |
 |
 |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 |
现象 |
结论 |
|
| A |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中有SO42- |
| B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+,无K+ |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2 (SO4 )3、 Na2 SO4、 KAl(SO4)2三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为
| A.3:2:3 | B.3:1:2 | C.2:6:3 | D.1:1:1 |
下列对三种有机物的叙述不正确的是(—SH的性质类似于—OH)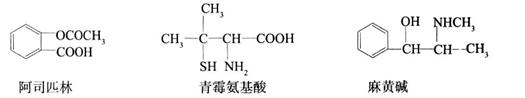
| A.三种有机物都能发生酯化反应 |
| B.青霉氨基酸不能与盐酸反应,但能与NaOH反应 |
| C.麻黄碱的分子式为C10H15ON,苯环上的一氯代物有3种 |
| D.阿司匹林能与适量NaOH反应生成可溶性阿司匹林 |
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
| A.由mXa+与nYb-,得m+a=n-b |
| B.X2-的还原性一定大于Y- |
| C.X,Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY |