下列离子方程式正确的是
| A.Cl2通入水中:Cl2 + H2O = 2H+ + Cl— + ClO— |
| B.双氧水中加入稀硫酸和KI溶液:H2O2 + 2H+ + 2I— = I2 + 2H2O |
| C.NaHCO3溶液与稀H2SO4反应:CO2-3+2H+=H2O+CO2↑ |
| D.Na2S2O3溶液中加入稀硫酸:2S2O32—+4H+ = SO42— + 3S↓ + 2H2O |
一定温度 下, 向aL的密闭容器中加入2molNO2(g), 发生如下反应:2NO2
下, 向aL的密闭容器中加入2molNO2(g), 发生如下反应:2NO2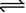 2NO+O2,此反应达到平衡的标志是()
2NO+O2,此反应达到平衡的标志是()
| A.单位时间内生成2nmolNO同时生成2nmolNO2 |
| B.混合气体中NO2、NO和O2的物质的量之比为2:2:1 |
| C.单位时间内生成2nmolNO同时生成nmolO2 |
| D.混合气体的颜色变浅 |
在2升的密闭容器中,发生以下反应:2A(g)+ B(g)  2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是()
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是()
| A.1.6 mol | B.2.8 mol | C.2.4 mol | D.1.2 mol |
反应2A(g) 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()
| A.加压 | B.减压 | C.减少E的浓度 | D.降温 |
下列说法不正确的是()
| A.体系有序性越高,熵值就越低 | B.自发过程将导致体系的熵增大 |
| C.吸热反应一定不可以自发进行 | D.同种物质气态时熵值最大 |
下列反应属于吸热反应的是 ()
A.C6H12O6(葡萄糖aq)+6O2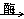 6CO2+6H2O 6CO2+6H2O |
| B.CH3COOH+KOH=CH3COOK+H2O |
| C.A+B=C+D;ΔH <0 |
| D.反应物的键能大于生成物的键能 |