在下列物质:A 烧碱 B 硫酸 C 干冰 D 硫酸钡 E 纯碱 F 铁
(1)既不是电解质,也不是非电解质的是 。
(2)纯碱的电离方程式是 。
(3)烧碱溶液与稀硫酸混合,发生反应的离子方程式为________________。
(4)将干冰升华后所得的气体通入过量烧碱溶液中,发生反应的离子方程式为 。
(5)a、b、c、d是Na2CO3、BaCl2、HCl、AgNO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
| 反应物 |
a+b |
c+d |
a+d |
a+c |
b+d |
| 现象 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
无色气体 |
① b是 (用化学式填写)。
② 写出a+c反应的离子方程式 。
已知乙烯能发生以下转化: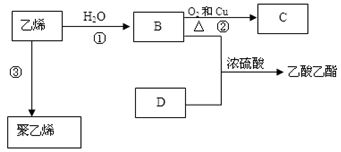
(1)乙烯的结构式为:。
(2)写出化合物官能团的化学式及名称:
B中含官能团名称;D中含官能团名称;
(3)写出反应的化学方程式
①:反应类型:
②:反应类型:
③:反应类型:
(有机化学基础)饮料果醋中含有苹果酸(MLA),其分子式为C4H6O5。0.1 mol苹果酸与足量NaHCO3溶液反应能产生4.48 L CO2(标准状况),苹果酸脱水能生成使溴水褪色的产物。苹果酸经聚合生成聚苹果酸(PMLA)。
(1)B的结构简式为:_____________,D中官能团的名称是______________。
(2)MLA的核磁共振氢谱有________组峰。任写一种与MLA具有相同官能团的同分异构体的结构简式__________________________。
(3)写出E→F转化的化学方程式:_____________________,
(4)上述转化关系中步骤③和④的顺序能否颠倒?________(填“能”或“不能”),说明理由:________________________
(5)写出聚苹果酸(PMLA)的一种可能的结构简式____________________。
乙烯是来自石油的重要有机化工原料,它的产量可以用来衡量一个国家的石油化工发展水平。结合以下路线回答:
已知:
(1)乙烯分子中有_ _个原子共面。
(2)CH3CH2OH中官能团的名称是 __。
(3)反应I的化学方程式是_________________,反应类型是__ ___。
(4)反应IV的化学方程式是__________,反应类型是 _。
选做【选修 5 :有机化学基础】有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为: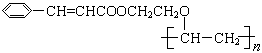 。按下图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。
。按下图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。
已知:①
②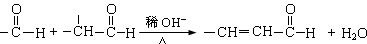
回答下列问题:
(1)试剂Ⅰ的名称是_________;B→C的反应类型是____________。
(2)质谱图显示A的相对分子质量是80.5;A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2∶2∶1,则A的结构简式为_______________。
(3)写出下列反应的化学方程式。
①D→E的反应 __________________________。
②C与F的反应 _________________________。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加到饱和溴水中后,有白色沉淀生成,该物质的结构简式为 _________________。
A是化学实验室中最常见的有机物,易溶于水有特殊香味,并能进行如图所示的多种反应。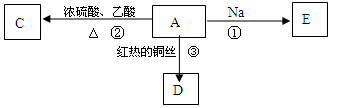
(1)物质A和C的结构简式A;C__________。
(2)反应②的类型__________________。
(3)反应①的化学反应方程式 _______________________。
(4)反应③的化学反应方程式 ________________________。