科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒。这是因为对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化合物。通过以上信息填空:
(1)维生素C具有 (填“氧化性”或“还原性”)。
(2)上述过程中+5价砷类物质作为 (填“氧化剂”或“还原剂”),+5价砷元素发生 反应(填“氧化”或“还原”);2mol +5价砷完全转化为 +3价砷,共转移 个电子(用NA表示阿伏加德罗常数)。
(1)将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为________,该混合气体的平均摩尔质量为___________。
(2) 同温同压下,质量相同的五种气体:① CO2② H2③ O2④ CH4⑤ SO2
所占的体积由大到小的顺序是(填序号,下同)_________________;
所含原子数由多到少的顺序是__________________________;
密度由大到小的顺序是_________________________________。
(3)标准状况下将224LHCl气体完全溶于1L水中,所得溶液的密度为1.1g/cm3,则所得稀盐酸的质量分数为____________, 物质的量浓度为_________________。
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________________mol。
(2)该气体所含原子总数为________________个。
(3)该气体在标准状况下的体积为_________________L。
(4)该气体在标准状况下的密度为_______________ g/L。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________________mol/L。
课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源B 极的名称是___________。
(2)甲装置中电解反应的总化学方程式是:________________。
(3)设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是__________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是__________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变”)。
(5)装置丁中的现象是________________________________________。
(6)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为mol/L。
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、Ba2+、CO32—、SO42—。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g。 |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断原混合物中一定不存在的离子是________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol·L-1) |
(3)试确定K+是否存在?________,判断的理由是_______________________________________________。
(12分)A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):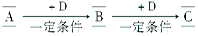
试回答:
(1)若D是具有氧化性的单质,A元素属于主族金属元素,则A为________(填元素符号)。
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示)____________________________________________________;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式:。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式:
______________________________、_________________________________。