下列实验操作正确的是( )
| A.把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中。 |
| B.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出。 |
| C.将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气。 |
| D.用萃取的方法分离汽油和煤油。 |
该同学用如下装置进行实验,分析影响反应速率的因素。实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示。
| 实验Ⅰ(断开K)1分钟水滴数 |
34 |
59 |
86 |
117 |
… |
102 |
| 实验Ⅱ(闭合K)1分钟水滴数 |
58 |
81 |
112 |
139 |
… |
78 |
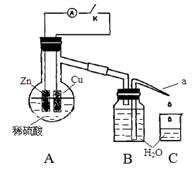
下列说法不正确的是
A.实验Ⅰ中化学能主要转化为热能
B.实验Ⅱ中化学能主要转化为电能
C.反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率
D.反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ
室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示。下列有关说法不正确的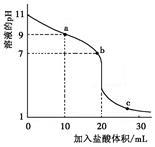
| A.该一元碱溶液浓度为0.100 0 mol·L-1 |
| B.a、b、c点的水溶液导电性依次增强 |
| C.室温下,MOH的电离常数Kb=1×10-5 |
| D.b点:c(M+)+c(MOH)=c(Clˉ) |
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001 mol/(L·s) |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的 |
| C.其他条件不变时,若增大压强,则物质Y的转化率减小 |
| D.其他条件不变时,若升高温度,X的体积分数增大,则该反应的ΔH>0 |
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如右图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-=H2↑+2OH- |
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是()
| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O |