某校化学兴趣小组在实验中发现一瓶溶液,标签上标有“CaCl2 0.1 mol·L-1”的字样,下面是该小组成员对溶液的叙述,正确的是( )
| A.配制1 L该溶液,可将0.1 mol CaCl2溶于1 L水中 |
| B.Ca2+和Cl-的物质的量浓度都是0.1 mol·L-1 |
| C.从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05 mol·L-1 |
| D.将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.1 mol·L-1 |
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是( )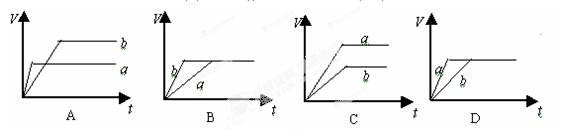
常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为( )
A.0.01mol·L-1 B.0.05mol·L-1C.0.017 mol·L-1 D.0.50mol·L-1
室温时某无色溶液pH=6.0,则向该溶液中分别滴入甲基橙、石蕊试液、酚酞试液,溶液的颜色分别变为( )
| A.红色、紫色、红色 | B.黄色、红色、无色 |
| C.黄色、紫色、无色 | D.黄色、紫色、红色 |
用0.1 mol•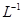 的盐酸滴定0.10 mol•
的盐酸滴定0.10 mol•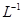 的氨水,滴定过程中不可能出现的结果是( )
的氨水,滴定过程中不可能出现的结果是( )
A. > >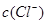 , , > > |
B. = =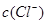 , , = = |
C.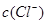 > > , , > > |
D.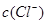 > > , , > > |
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
B.Ksp(AgCl) > Ksp(AgI) ,由此可以判断AgCl(s) + I-(aq)  AgI(s)+ Cl-(aq)能够发生 AgI(s)+ Cl-(aq)能够发生 |
| C.当温度升高时,弱酸的电离平衡常数Ka变小 |
| D.化学平衡常数不变时,说明化学反应已达化学平衡状态 |