实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液应称取NaOH的质量是 克。
除量筒、烧杯、玻璃棒、胶头滴管外还需要的其它仪器是 。
(2)容量瓶上需标有以下五项中的 ;
① 温度 ② 浓度 ③ 容量 ④ 压强 ⑤ 刻度线
(3)下列配制的溶液浓度偏低的是 ;
| A.定容时俯视刻度线 |
| B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面 |
| C.加蒸馏水时不慎超过了刻度线 |
| D.配制前,容量瓶中有少量蒸馏水 |
根据下面物质间转换的框图,回答有关问题:
(1)写出框图中物质A、D、F、G分别指代物质的化学式:
A. D. F. G.
(2)写出⑤反应的化学方程式 。
在⑤反应中当有6.6gD 足量的Na2O2参加反应时会造成固体增重 克 。
(3)写出④的离子反应方程式 。
【化学——选修5:有机化学基础】
由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。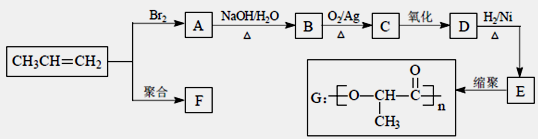
(1)聚合物F的结构简式是______________________。
(2)D的结构简式是 。
(3)B转化为C的化学方程式是 。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是 __________________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体为_______________________。
[化学—有机化学基础] (15分)
阿斯巴甜作为强烈甜味剂被广泛应用于食品、饮料、糖果等,工业上可以用苯丙氨酸甲酯和α-氨基丁二酸为原料合成: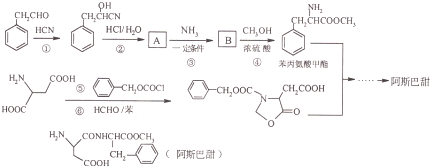
已知:RCN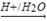 RCOOH;
RCOOH;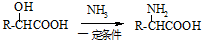
(1)A中含氧官能团的名称为_________________________ ;
(2)①、⑤的反应类型依次为___________、______________;
(3)B的同分异构体中同时符合下列条件的有2种,写出其结构简式______________;
①有三种化学环境不同的氢原子;②含苯环的中性物质
(4)写出阿斯巴甜与足量NaOH水溶液充分反应的化学方程式_________________________;
(5)写出以1,3-丙二醇(HOCH2-CH2-CH2OH)为原料制备 的合成路线流程(无机试剂任选).合成路线流程示例如下
的合成路线流程(无机试剂任选).合成路线流程示例如下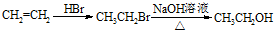 :
:
_______________________________________________________________________________。
[化学—物质结构与性质]
A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)A、B的元素符号依次为_____________、_______________;
(2)AC2与BC2分子的立体结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是___________________________________________;
(3)D的核外电子排布式为________________________,在形成化合物时它的最高化合价为__________。
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应,回答下列问题: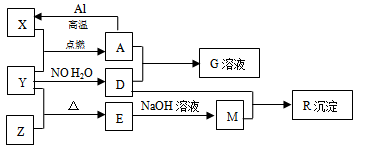
(1)M中存在的化学键类型为_______________________;
(2)一定条件下,Z与H2反应转化为ZH4,ZH4的电子式为_______________;
(3)已知A与1molAl反应转化为X时(所有物质均为固体)的热效应为akJ,则该反应的热化学方程式为_______________;
(4)A与过量D的稀溶液反应生成G的离子方程式为_______________;
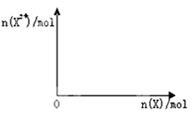
(5)向含4molD的稀溶液中,逐渐加入X粉末至过量.假设生成的气体只有一种,请在坐标系图乙中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。