下列说法中正确的是:(均在常温下)( )
①pH=1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。
②pH=2的盐酸和pH=1的醋酸,c(H+) 之比为2∶1。
③在Na2CO3和NaHCO3溶液中均存在下列关系c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
④已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;
则三者关系为:Ka·Kh=Kw
⑤甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等
体积混合,混合液pH可能等于7
| A.①②③ | B.③④⑤ | C.②④⑤ | D.①③⑤ |
做实验时不小心使皮肤上沾了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(H2C2O4乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:
MnO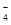 + C2O
+ C2O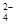 + H+ === CO2↑ + Mn2+ +
+ H+ === CO2↑ + Mn2+ +
下列有关叙述不正确的是
| A.该反应的氧化剂为KMnO4 |
B.发生还原反应的是C2O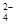 |
| C.该离子方程式右侧方框内的产物是H2O |
| D.16mol H+参加反应时,电子转移10 mol |
已知下列反应:Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2O(Ⅰ);
5Cl2+I2+6H2O===10HCl+2HIO3(Ⅱ)。下列说法正确的是
| A.还原性:CoCl2>HCl>I2 |
| B.氧化性:Co2O3>Cl2>HIO3 |
| C.反应Ⅰ中HCl是氧化剂 |
| D.反应Ⅱ中Cl2发生氧化反应 |
下列离子反应方程式表示正确的是
| A.过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-===CaCO3↓+CO32-+2H2O |
| B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+===4Fe3++2H2O |
| C.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O |
| D.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-===BaSO4↓+H2O |
下列各组离子在指定溶液中能大量共存的是
| A.使酚酞变红色的溶液:Fe3+、Mg2+、SO42-、NO3- |
| B.KNO3的酸性溶液:Fe2+、Ca2+、Al3+、Cl- |
| C.常温下,由水电离出的c(H+)=1.0×10-10 mol·L-1的溶液:NH4+、Na+、SiO32-、CO32- |
| D.透明的溶液:Cu2+、Fe3+、NO3-、MnO4- |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,22.4 L己烷中C—C共价键数目为5NA |
| B.0.1 mol·L-1 AlCl3溶液中含有氯离子数为0.3NA |
| C.1 mol Fe在1 mol Cl2中充分燃烧,转移电子数为3NA |
| D.12 g金刚石中含有的共价键数为2NA |