已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,相关数据如下表所示。
| |
溶质的物质的量浓度/mol·L-1 |
溶质的质量分数 |
溶液的密度/g·cm-3 |
| 硫酸 |
c1 |
w1 |
ρ1 |
| 氨水 |
c2 |
w2 |
ρ2 |
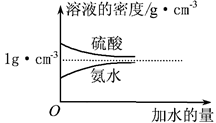
请根据表中信息,回答下列问题:
(1)表中硫酸的质量分数w1为________(不写单位,用含c1、ρ1的代数式表示);
(2)物质的量浓度为c1 mol·L-1,质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1,质量分数_______ w1/2 (填“>”、“<”或“=”);
(3) 质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_______ρ2 g·cm-3(填“>”、“<”或“=”);
(4)如果蒸发溶剂使硫酸的的质量分数变为2 w1,则所得硫酸的物质的量浓度 2 c1(填“>”、“<”或“=”)。
在标准状况下,将质量为相同状况下同体积氢气质量16倍的CO2和CO的混合气体,充满盛有Na2O2且容积为2.24 L的密闭容器中(假设固体的体积忽略不计),用间断发生的电火花引发反应,使可能发生的反应充分进行。试完成下列问题:
(1)反应前充入容器中的CO2和CO的物质的量各是多少?
(2)最后容器中的生成物有哪些?其质量各是多少?
已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。请通过计算和推理完成下列各小题:
(1)取A与足量的盐酸反应:
①若n(A)为定值,生成气体的量即为定值,则A的组成可能有________种。
②若m(A)为定值,生成气体的量为定值,则A的可能组成是(填写化学式):________、________;________、________;________、________。(可以不填满)
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为10.0 g,则混合固体A的总物质的量是多少?
在25 ℃,101 kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气体中V(CO)________=L,V(H2)=______L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________。
(3)若剩余气体的体积为a L,则原a的取值范围是________。
常温下,两种常见无色无味的气体A和B组成的混合气体(A的相对分子质量小于B的相对分子质量)。经分析混合气体中总共只含氧和碳两种元素,但不论A和B以何种比例混合,氧和碳的质量比总是大于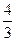 。
。
(1)在下表中填出A和B可能的分子式。(不一定填满)
(2)当氧和碳的质量比等于2时,试确定A和B的可能组成以及A与B的物质的量之比。
铝和硅均能与强碱溶液反应,离子方程式分别为:
2Al+2OH-+2H2O====2 +3H2↑
+3H2↑
Si+2OH-+H2O==== +2H2↑
+2H2↑
现有一铁、硅、铝的混合物13.0 g,当与足量盐酸反应时,生成标准状况下的氢气11.2 L;若将等质量的混合物与足量的NaOH溶液反应时,生成的H2在标准状况下也是11.2 L。求原混合物中各组分的质量。