化学反应A(g)+B(g)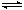 C(g)+D(g)ΔH<0,850℃时,K="l" t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:
C(g)+D(g)ΔH<0,850℃时,K="l" t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:
t℃时物质的浓度(mol·L-1)变化
| 时间/min |
A |
B |
C |
D |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100[科网] |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
(1)计算t℃该化学反应的平衡常数: 。
(2)t℃ 850℃(填大于、小于或等于)。判断依据是 。
(3)反应在4min~5min之间,平衡 (填“向左”、“向右”或“不”)移动,可能的原因是 。
a.增加A的浓度 b.增加D的浓度 c.增加C的浓度 d.使用催化剂
(4)某温度下反应C(g)+D(g) 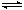 A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度 850℃(填大于、小于或等于):
A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度 850℃(填大于、小于或等于):
现有A、B、C、D四种常见的短周期主族元素,其原子序数依次增大.其中A、B是同周期相邻元素,且A单质及其氢化物是重要的工业生产原料;C、D是同周期元素,且在该周期中,分别为原子半径最大和最小的元素,C、D最外层电子数之和与B的原子序数相等,回答下列问题:
(1)B元素的名称为,C元素在周期表中位于第周期第族.
(2)工业上由A单质合成其氢化物的化学反应方程式为:.
(3)当今工业电解CD饱和水溶液的装置名称是,阳极电极反应式为,溶液的pH将(填“增大”、“减小”或“不变”),若有1mol电子转移,生成气体体积之和是L(标准状况下).
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129°C;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式:。
(2)NF3的沸点比NH3的沸点(-33°C)低得多的主要原因是。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是,配位数为。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
①在周期表中,最可能处于同一族的是和。
②T元素最可能是(填“s”、“p”、“d”、“ds”等)区元素,位于族。
若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为,其中心原子的杂化方式为。
2,3-二氢呋喃是抗肿瘤药物的中间体,也用于电子化学品和香料中,可由丙烯为原料合成: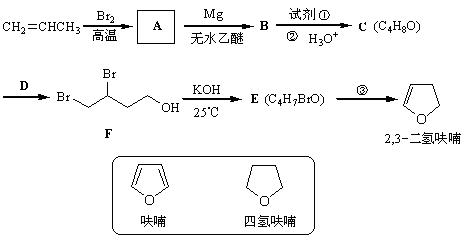
已知: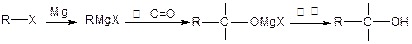
(1)写出A、E的结构简式: A ________________ E ________________。
(2)试剂①是___________,该步反应类型是反应。
(3)反应③的条件是____________,该步还产生另一有机副产物:____________。
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式。
①没有支链,且一取代产物只有两种;②与银氨溶液不发生银镜反应;
(5)四氢呋喃还可以由化合物G (C4H9ClO)在氢氧化钠作用下制得,请写出该反应的方程式___________。
(6)化合物 是合成某些药物的中间体。试设计合理方案由化合物
是合成某些药物的中间体。试设计合理方案由化合物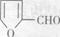 合成
合成 。提示:①合成过程中无机试剂任选;②
。提示:①合成过程中无机试剂任选;②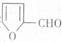 在400摄氏度金属氧化物条件下能发生脱羰基反应;③合成反应流程图表示方法示例如下:
在400摄氏度金属氧化物条件下能发生脱羰基反应;③合成反应流程图表示方法示例如下: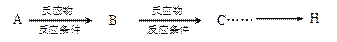
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下: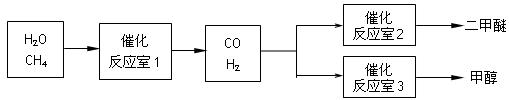
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。
在其它条件不变的情况下降低温度,逆反应速率将(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为。
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
① P1P2 (填“<”、“>”或“=")。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”。下同。),平衡常数。
③在P1压强下,100℃时,CH3OH(g)  CO(g) + 2H2(g)反应的平衡常数为
CO(g) + 2H2(g)反应的平衡常数为
(用含a、V的代数式表示)。
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列全)。
请回答下列问题:
(1)B的电子式为。
(2)J、K是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式。
(3)汽车尾气中常含有D。B在加热和催化剂存在的条件下能消除D的污染。已知:
①4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H=-905 kJ·mol-1
4NO(g)+6H2O(g) △H=-905 kJ·mol-1
②4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1268 kJ·mol-1
2N2(g)+6H2O(g) △H=-1268 kJ·mol-1
则B与D反应的热化学方程式为。
(4)有人认为:“表面化学”研究成果能使B和D的反应在催化剂表面进行时的效率大大提高,从而使污染物D的转化率大大提高。请你应用化学基本理论对此观点进行评价:。