下列说法或表示方法正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(石墨)→C(金刚石);ΔH=" +11.9" kJ/mol可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=" -57.3" kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ |
| D.在101kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);ΔH=" -285.8" kJ/mol |
用惰性电极电解CuSO4和NaCl的混合溶液,开始时阴极和阳极上析出的物质分别是( )
| A.H2和Cl2 | B.Cu和Cl2 | C.H2和O2 | D.Cu和O2 |
关于如图所示的原电池,下列说法正确的是()
| A.电子从锌电极通过电流表流向铜电极 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.取出盐桥后,电流计的指针仍发生偏转 |
| D.铜电极上发生的电极反应是2H++2e﹣═H2↑ |
某反应过程中体系的能量变化如图所示,下列说法错误的是( )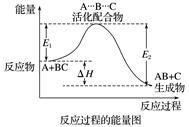
A.反应过程可表示为 |
| B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能 |
| C.正反应的热效应ΔH=E1-E2<0,所以正反应为放热反应 |
| D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应 |
对于:2C4H10(g)+13O2(g)═ 8CO2(g)+10H2O(l);△H=﹣5800kJ/mol的叙述中不正确的是( )
| A.该反应的反应热为△H=﹣5800kJ/mol,是放热反应 |
| B.该反应的△H与各物质的状态有关,与化学计量数也有关 |
| C.该式的含义为:25℃、101kPa下,2molC4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ |
| D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol |
已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1
N2(g)+O2(g)═2NO(g)△H=+180kJ•mol﹣1
则2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H是( )
| A.﹣386 kJ•mol﹣1 | B.+386 kJ•mol﹣1 | C.﹣746 kJ•mol﹣1 | D.+746 kJ•mol﹣1 |