在0.lmol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向正反应方向移动 |
| B.加水,反应速率增大,平衡向逆反应方向移动 |
| C.滴加少量0.lmol/L HCl溶液,溶液中c(H+)减少 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
.维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟橡胶。它的结构简式如右,合成它的单体是:( )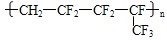
| A.氟乙烯和全氟异丙烯 | B.1,1—二氟乙烯和全氟丙烯 |
| C.1—三氟甲基—1,3—丁二烯 | D.全氟异戊二烯 |
某烃分子中有1个环状结构和2个双键,它的化学式可能是 ( )
| A.C2H4 | B.C7H8 | C.C5H6 | D.C10H8 |
在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
| A.20% | B.40% | C.60% | D.80% |
有人认为CH2 = CH2与Br2的加成反应,实质是Br2先断裂为Br+ 和Br-,然后Br+首先与CH2 = CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合。根据该观点如果让CH2 = CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能的是( )
| A.BrCH2CH2Br | B.ClCH2CH2Cl | C.BrCH2CH2I | D.BrCH2CH2Cl |
如图所示装置,电流计的指针发生偏转,正极变粗,负极变细,符合这种情况的是( )
| A.正极Cu,负极Al,S为浓HNO3 | B.正极Ag,负极Fe,S为CuSO4 |
| C.正极Al,负极Cu,S为浓HNO3 | D.正极Zn,负极Cu,S为CuSO4 |