根据原子结构及元素周期律的知识,下列推断正确的是( )
| A.同周期元素含氧酸的酸性随核电荷数的增加而增强 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl‾、S2‾、K+、Ca2+半径逐渐减小 |
D.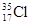 与 与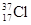 得电子能力相同 得电子能力相同 |
下列反应的离子方程式书写正确的是
A.明矾溶液中加入过量的氨水: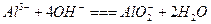 |
B.次氯酸钙溶液中通人过量二氧化碳: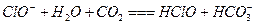 |
C.用石墨作电极电解饱和食盐水: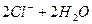  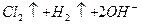 |
D.澄清的石灰水中加人少量的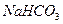 溶液: 溶液: |
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
| A.无水硫酸铜、蔗糖 | B.硅胶、硫酸亚铁 |
| C.食盐、硫酸亚铁 | D.生石灰、食盐 |
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是()
| A.①②③④ | B.①②⑤⑥ | C.③⑤⑥⑦ | D.①③④⑦ |
阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是()
(1)0.25molNa2O2中含有的阴离子数为0.5×6.02×1023
(2)7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023
(3)2.24LCH4中含有的原子数为0.5×6.02×1023
(4)250mL2mol/L的氨水中含有NH3·H2O的分子数为0.5×6.02×1023
(5)1L 1mol·L―1的HAc溶液中含有6.02×1023个氢离子
(6)18g D2O(重水)完全电解,转移6.02×1023个电子
(7)22.4L SO2气体,所含氧原子数为2×6.02×1023
(8)14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023
| A.2个 | B.3个 | C.5个 | D.6个 |
某酸性溶液中只有Na+、 、H+、
、H+、 四种离子。则下列描述正确的是( )
四种离子。则下列描述正确的是( )
| A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
C.加入适量的NaOH,溶液中离子浓度为c( )>c(Na+)>c(OH-)>c(H+) )>c(Na+)>c(OH-)>c(H+) |
D.加入适量氨水,c( )一定大于c(Na+)、c(NH4+)之和 )一定大于c(Na+)、c(NH4+)之和 |