下列图示与对应的叙述相符的是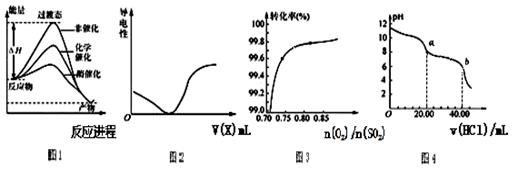
| A.由图1所示曲线可知,化学催化比酶催化的效果好 |
| B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X可能是SO2,不可能为Cl2 |
C.在其它条件不变时,2SO2(g)+ O2(g)  2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 |
| D.图4是用0.l000 mol/L的盐酸滴定20.00 mL 0.l000mol/LNa2CO3溶液的曲线,从a→b点反应的离子方程式为:CO32--+2H+=CO2↑+H2O |
在生产过程中,要促进反应的完成程度,以提高原料的利用率或转化率,常采取的措施是( )
| A.使用催化剂 |
| B.增大某一反应物的浓度 |
| C.固体粉碎,增大接触面积 |
| D.增大气体反应物的压强(正反应是气体体积减小的反应) |
国家有关部门规定,从2001年7月1日在全国禁用含铅汽油,全面推广使用无铅汽油。无铅汽油的含意是( )
| A.汽油中不含铅元素 |
| B.汽油中不人为的加入含铅物质 |
| C.汽油中含铅元素在规定的指标范围内 |
| D.不含杂质的纯净汽油 |
2006年5月24日夜间,一辆油罐车在贝宁经济首都科托努以北500多公里的波尔加起火,事故现场发现了23具被烧焦的尸体,造成至少35人死亡,60多人受伤。这辆由科托努开往贝宁北部的油罐车因发生故障停在路边,附近的居民用管子偷吸油罐车里的汽油时,其中一人携带的油灯引燃了油罐车。下面有关汽油性质的描述正确的是()
| A.汽油具有易燃性 |
| B.汽油燃烧时,有黑烟产生 |
| C.汽油不易蒸发 |
| D.汽油是纯净物 |
下列物质中,作为燃料时对空气没有污染的是( )
| A.原油 | B.氢气 | C.汽油 | D.煤 |
下列属于高分子化合物且在自然界中原来并不存在的是( )
| A.淀粉 | B.纤维素 | C.聚乙烯 | D.蛋白质 |