电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
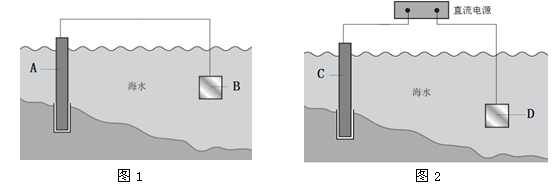
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:__________________________。
(2)图2中,钢闸门C做_____极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为______________________,检测该电极反应产物的方法是_______________________。

(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的极________(填“正”或“负”)。F电极上的电极反应式为___________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_______。
(9分)有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
①X与Z、Y与W分别同主族;②X、Z、W分别与Y都能形成两种常见的化合物;
③Y的阴离子与Z的阳离子的核外电子排布相同;
④这4种元素的单质中有一种易溶于CS2。(用推出的元素符号回答)
(1)若把X2Y2看成二元弱酸,请写出X2Y2的电离方程式 _________________________:______________________
(2)写出由Y与Z形成的化合物Z2Y2的电子式________,其化学键类型有_____,____
(3)写出均由这4种元素组成的两种化合物在水溶液中发生反应的离子方程式:__________________________________。
(4)X、Y两种元素的单质已被应用于美国的阿波罗宇宙飞船的燃料电池中,请写出该燃料电池的正极的电极反应式__________________________
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B、C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
(1)写出化学式:A_________、E__________、X __________.
__________.
(2)在反应①~⑦中,不属于氧化还原反应的是________(填编号).
(3)反应⑥的离子方程式为:_________________________________________________.
(4)反应⑦的化学方程式为__________________________________________________;
该反应中每消耗0.3 mol的A,可转移 电子________ mol.
电子________ mol.
(5)写出D的溶液与小苏打溶液反应的离子方程式:___ ____________________________
____________________________
有两包白色粉末,只知分别是K2CO3和NaHCO3,请你写出鉴别方法(写出3种方法可得6分,3种以上方法得7分)
(1)。
(2)。
(3)。
。
A、B、C、D、E、F、G、H、I、J、K都是中学课本常见物质,它们与X具有下图相互转化关系。
已知:①A、D、E、K为单质,其中E为黑色固体;
②X、A、B、C、D为气体,B、C均能使澄清石灰水变浑浊,C、D均能使品红溶液褪色;
③H是一种红棕色固体氧化物。
请回答下列问题:
(1)B分子的电子式:_______________;
(2)J与氨水反应的离子方程式:_______________________________________;
反应全过程的现象是:_____________________________________________;
(3)E和F反应的化学方程式:__________________________________________;
(4)气体X中含有三种元素,分子中各原子均达到8电子稳定结构,其对H2的相对密度为30,试推断X的分子式:___________;X的结构式:____________。
某溶液中可能含有OH—,CO32—,AlO2—,SiO32—,SO42—,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示:
回答下列问题:(已知:AlO2—+HCO3—+H2O=Al(OH)3↓+ CO32—)
(1)原混合溶液中一定含有的离子是:___________________________________;
(2)AB段反应的离子方程式是:____________________________________________;
(3)发生AB段反应的离子与发生BC段反应的物质两者物质的量之比为:____________。