某溶液中含K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-中的若干种,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰。
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成。
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色。下列说法正确的是
| A.原溶液中肯定不含Fe2+、NO3-、SiO32-、I- |
| B.原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- |
| C.步骤Ⅱ中无色气体是NO气体,无CO2气体产生 |
| D.为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
下列推断正确的是
| A.SiO2是酸性氧化物,能与NaOH溶液反应 |
| B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 |
| C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
下列说法正确的是
| A.能通过化合反应制得FeCl2和Fe(OH)3 |
| B.7.8gNa2O2与CO2完全反应,转移0.2mol电子 |
| C.Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
分类是化学学习与研究的常用方法,下列分类正确的是
| A.Na2O、MgO、Al2O3均属于碱性氧化物 |
| B.石灰石、生石灰、熟石灰均属于碱 |
| C.酸、碱、盐之间发生的反应均属于复分解反应 |
| D.混合物、分散系、胶体从属关系如图所示 |
8.34gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是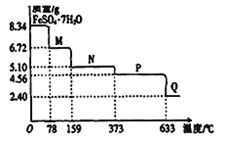
| A.温度为78℃时固体物质M的化学式为FeSO4•5H2O |
| B.温度为l59℃时固体物质N的化学式为FeSO4•3H2O |
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4 FeO+SO3↑ FeO+SO3↑ |
| D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3 |
下列各项反应对应的图像错误的是
| A.图1:将饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体 |
| B.图2:将稀盐酸逐滴加入一定量偏铝酸钠溶液中 |
| C.图3:将二氧化硫逐渐通入一定量氯水中 |
| D.图4:将铜粉逐渐加入一定量浓硝酸中 |