(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g)  HCOOCH3(g)+2H2(g) △H>O
HCOOCH3(g)+2H2(g) △H>O
第二步:HCOOCH3(g)  CH3OH(g)+CO(g) △H>O
CH3OH(g)+CO(g) △H>O
第一步反应的机理可以用图1表示,中间产物X的结构简式为___________。


(2)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为:_____________。
(3)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4、(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质。上述两步中消耗CO的物质的量之比为______________。
(4)为安全起见,工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图3 所示。这种传感器利用原电池原理,则该电池的负极反应式为:_____________________。
标况下,在100 mL0.1mol·L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某浓度的稀盐酸,滴加盐酸的体积与生成气体的情况如图所示。
(假设生成的CO2全部逸出)。
求:(1)该稀盐酸物质的量浓度c(HCl)。
(2)滴加稀盐酸至50mL时共产生气体体积。
(3)滴加盐酸前溶液中所含溶质的成分及各自的物质的量浓度。
某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤: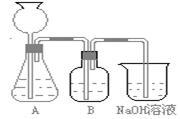
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程____________________、____________________________。
此方案第一步的实验装置如下图所示:
(2)加入反应物前,如何检查整个装置的气密性______________________________________。
(3)装置B中盛放的试剂是______________,
作用是___________________ ____________。
(4)在实验室通常制法中,装置A还可作为下列_____________ 气体的发生装置(填序号)。
①CH2==CH2②H2S③CH4④CH≡CH⑤H2 (5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。
(5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。
(6)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g / mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为____________________。
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O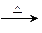 乙+丙 b.乙
乙+丙 b.乙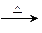 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是:。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:_。
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为__。
有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I—、CO32—等离子,现分别取溶液进行下列实验:
(1)加入AgNO3,溶液有黄色沉淀生成;
(2)加入淀粉,未见蓝色;
(3)在逐滴加入1mol·L—1NaOH溶液的过程中,未闻到刺激性气体,随NaOH溶液的滴入,产生沉淀的量如图所示,
试确定:
(1)溶液中一定存在的离子有;
(2)其中阳离子物质的量分别为。
某化学反应的反应物和产物如下:
KMnO4+ KI+ H2SO4→ MnSO4 + I2 + KIO3+ K2SO4 + H2O
(1)该反应的氧化剂是。
(2)如果该反应方程式中I2和KIO3的化学计量数都是5
①KMnO4的化学计量数是。
②在下面的化学式上标出电子转移的方向和数目
KMnO4+ KI + H2SO4 →
(3)如果没有对该方程式中的某些化学计量数作限定,可能的配平化学计量数有许多组。原因是。