X、Y均为元素周期表VIIA族中的两种元素。下列叙述中,能够说明X的原子得电子能力比Y强的是
| A.原子的电子层数:X>Y | B.对应的简单离子的还原性:X > Y |
| C.气态氢化物的稳定性:X>Y | D.氧化物对应水化物的酸:X>Y |
如图用石墨作电极的电解池中,放入某足量蓝色溶液500mL进行电解,观察到A电极表面有红色固体生成,B电极有无色气体生成;通电一段时间后,取出A电极,洗涤、干燥、称量,A电极增重1.6g。下列说法错误的是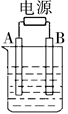
| A.图中B极同电源正极相连 |
| B.该蓝色溶液可能是Cu(NO3)2或CuCl2溶液[ |
| C.电解后溶液的pH约为 1(溶液体积变化忽略不计) |
| D.要使电解后溶液恢复到电解前的状态,则可加入2 g CuO |
下图为元素周期表中短周期的一部分,下列说法错误的是
| X |
Y |
| Z |
W |
A.Z的原子序数可能是X的两倍
B.单质的活泼性可能是Y<Z
C.X、Z的最高价氧化物对应水化物可能均为强酸
D.分别由Y、W形成的单质可能都是原子晶体
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):
KMnO4+FeSO4+H2SO4=K2SO4+MnSO4+ Fe2(SO4)3+H2O
下列说法正确的是
| A.MnO4-是氧化剂,Fe3+是还原产物 |
| B.Fe2+的还原性强于Mn2+ |
| C.取反应后的溶液加KSCN溶液,可观察到有血红色沉淀生成 |
| D.生成1mol水时,转移2.5mol电子 |
设NA为阿伏加德罗常数的数值,下列说法错误的是
A.已知N2(g)+3H2(g)  2NH3(g)△H=-92.4 kJ·mol-1,当有3NA个电子转移时,△H变为-46.2 kJ·mol-1 2NH3(g)△H=-92.4 kJ·mol-1,当有3NA个电子转移时,△H变为-46.2 kJ·mol-1 |
| B.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
| C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D.2.9g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.01NA个 |
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2 2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是
2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是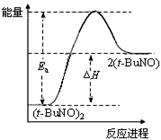
| A.反应在前10 min内的平均速率为ν(t-BuNO)=0.0375mol·L-1·min-1 |
| B.保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
| C.保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用右图表示 |
| D.保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |