研究N0x、SO2等大气污染气体的处理有重要意义。
(1)NO2可用水吸收,相应的化学方程式为 。利用反应:6NO2+8NH3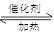 7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________L。
7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1;
2SO3(g) ΔH=-196.6 kJ·mol-1;
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1;
2NO2(g) ΔH=-113.0 kJ·mol-1;
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="_________" kJ·mol-1。(3)大气中SO2和NOx是形成酸雨的主要污染气体。某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。已知:Ksp(Ag2SO4)=1.20×10-5
SO3(g)+NO(g)的ΔH="_________" kJ·mol-1。(3)大气中SO2和NOx是形成酸雨的主要污染气体。某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。已知:Ksp(Ag2SO4)=1.20×10-5
请回答下列问题:
①该酸雨中肯定存在的离子有_______;肯定不存在的离子有______,说明其不存在的理由:_____。
②写出试液中滴加淀粉KI溶液所发生反应的离子方程式:____________。
③该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有2NO+O2=2NO2 、 NO2+SO2=SO3 + NO,再喷射适量蒸馏水即得硫酸型酸雨。说明NO的作用:____________。
(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成的NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
T=a℃ V=2L T=a℃ V=2L移动活塞
①判断甲容器中的反应达平衡的依据是 。(填写相应编号)
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2 mol NH3的同时消耗1 mol N2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K= ;平衡时,甲的压强P平= (用初始压强P0表示)。
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图所示。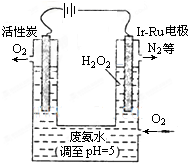
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________c(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为 。
③理论上电路中每转移3 mol电子,最多可以处理NH3·H2O的物质的量为 。
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有6个 键和1个大
键和1个大 键,苯是非极性分子
键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
研究N0x、SO2等大气污染气体的处理有重要意义。
(1)NO2可用水吸收,相应的化学方程式为 。利用反应:6NO2+8NH3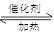 7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________L。
7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1;
2SO3(g) ΔH=-196.6 kJ·mol-1;
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1;
2NO2(g) ΔH=-113.0 kJ·mol-1;
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="_________" kJ·mol-1。(3)大气中SO2和NOx是形成酸雨的主要污染气体。某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。已知:Ksp(Ag2SO4)=1.20×10-5
SO3(g)+NO(g)的ΔH="_________" kJ·mol-1。(3)大气中SO2和NOx是形成酸雨的主要污染气体。某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。已知:Ksp(Ag2SO4)=1.20×10-5
请回答下列问题:
①该酸雨中肯定存在的离子有_______;肯定不存在的离子有______,说明其不存在的理由:_____。
②写出试液中滴加淀粉KI溶液所发生反应的离子方程式:____________。
③该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有2NO+O2=2NO2 、 NO2+SO2=SO3 + NO,再喷射适量蒸馏水即得硫酸型酸雨。说明NO的作用:____________。
反应物间进行微粒交换是化学反应的特征之一,置换反应、复分解反应、取代反应都属于反应物间进行微粒交换的化学反应。
(1)NaHCO3和NaOH的反应是NaHCO3电离的H+离子和NaOH电离出的 离子相互交换的反应。
(2)在浓硫酸作用下,羧酸与醇也是微粒交换的反应,请写出乙酸和乙醇反应的化学方程式: 。
(3)工业上利用铝热反应用铝粉和MnO2冶炼金属锰,写出化学方程式: 。
(4)工业上制取粗硅的反应也是一个置换反应,此反应的反应物中含有三种元素,这三种元素的非金属性由强到弱的顺序为 。与硅同周期的某元素,其最高价氧化物既可溶于强酸又可溶于强碱,请写出该氧化物溶于强碱的离子方程式: 。
(5)NH3和Cl2发生置换反应,当NH3过量时,NH3继续与HCl反应。当有3molCl2参与反应时,有
molNH3被氧化。
(6)(NH4)2CO3和H2CO3的反应也进行微粒交换,当往(NH4)2CO3溶液中通入一定量CO2至溶液呈中性时,溶液中HCO3-和NH4+的比值 (填“大于”“小于”或“等于”)1:1。
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)  5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 molCO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 molCO,测得CO2的体积分数随时间t变化曲线如图。请回答:
(1)T2时,0~0.5min内的反应速率v(CO)=___________。
(2)T1时化学平衡常数K=______________。
(3)下列说法不正确的是_______(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,C点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb<Kd |