W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的元素(不考虑稀有气体的原子半径);Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的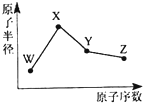
| A.简单离子半径:Z>X>W |
| B.最简单气态氢化物的稳定性:Y<Z |
| C.化合物XZW中既含离子键又含共价键 |
| D.Y的氧化物能与X的最高价氧化物对应的水化物反应 |
在实验室中,对下列事故或药品的处理正确的是( )
A. 漂白粉可长期放置在烧杯中 漂白粉可长期放置在烧杯中 |
B.金属钠燃烧时,不能用泡沫灭火 器灭火,应该用沙 器灭火,应该用沙 子灭火 子灭火 |
| C.氯水可以用无色透明的试剂瓶装保存 |
D.有大量的氯气泄漏时,用氢氧化钠 溶液浸湿软布蒙面,并迅 溶液浸湿软布蒙面,并迅 速离开现场 速离开现场 |
下列关于氯及其化合物的性质的说法,正确的是( )
| A.液氯、氯水、次氯酸都具有漂白性 |
| B.红热的铜丝在Cl2中燃烧产生棕黄色的雾;H2在Cl2中燃烧,火焰呈淡蓝色 |
| C.光照氯水有气泡逸出,该气体是Cl2 |
| D.氯气、氯水都可以与硝酸银溶液反应生成白色沉淀 |
向盛有紫色石蕊试液的试管中加入过量的Na2O2粉末,充分振荡后,不能观察到的现象是( )
| A.试管外壁发热 | B.溶液最后变为蓝色 |
| C.溶液先变蓝最后退色 | D.有气泡冒出 |
下列关于钠的说法中,正确的是( )
A.钠的化学性质很活泼,所以它在自然界中不 能以游离态存在 能以游离态存在 |
| B.钠可以把钛、锆、铌等金属从它们的氯化物的水溶液中置换出来 |
| C.实验后剩余的钠不可放回原试剂瓶中 |
| D.钠在空气中燃烧生成氧化钠,发出黄色火焰 |
一元硬币的外观有银白色的金属光泽,一些同学推测它可能是铁制成的。在讨论时,有同学提出:“我们可以先拿磁铁来吸一下。”就这一过程而言,属于科学探究中的()
| A.观察 | B.实 验 验 |
C.分类 | D.比较 |