H2和I2在一定条件下能发生反应:H2(g)+I2(g) 2Hl(g) △H="-a" kJ/mol。已知:
2Hl(g) △H="-a" kJ/mol。已知:
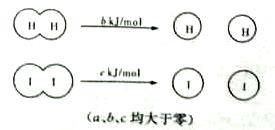
下列说法正确的是
| A.H2、I2和HI分子中的化学键都是非极性共价键 |
| B.断开2 mol Hl分子中的化学键所需能量约为(c+b+a))kJ |
| C.相同条件下,lmol H2(g)和lmol I2(g)总能量小于2 molHl(g)的总能量 |
| D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ |
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定)
| A.乙炔 | B.丙炔 | C.丁炔 | D.1,3 -丁二烯 |
下列化合物属于苯的同系物的是
|

乙醇分子结构中,各种化学键如图所示 ,关于乙醇在各种反应中断裂键的说明不正确的是
,关于乙醇在各种反应中断裂键的说明不正确的是
| A.和乙酸、浓H2SO4共热时断裂键② |
| B.和金属钠反应时断裂键① |
| C.和浓H2SO4共热至170℃时断裂②,⑤键 |
| D.在Ag催化下和O2反应时断裂①,③键 |
取一定质量的两种有机物组成的混合物,无论以何种比例混合,在足量的氧气中充分燃烧后生成的CO2和H2O的量总是相同的,则此混合物是
| A.甲烷和丙烷 | B.乙烯和丙烷 |
| C.甲醛和乙酸 | D.乙醇和丙醇 |
在下列反应中,硫酸只起催化作用的是
| A.乙醇和乙酸酯化 | B.苯的硝化反应 |
| C.乙酸乙酯水解 | D.乙醇在170℃时脱水生成乙烯 |