常温下,下列各组离子在指定溶液中能大量共存的是
| A.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| B.遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ |
| C.与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- |
| D.加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- |
下列有关物质的性质或应用说法不正确的是
| A.可用FeCl3溶液除去试管内壁上的难以刷去的铜迹 |
| B.浓硫酸能干燥氯气、一氧化碳等气体,说明浓硫酸具有吸水性 |
| C.二氧化硫具有漂白性,所以能使溴水和品红溶液褪色 |
| D.福尔马林、葡萄糖溶液与新制氢氧化铜悬浊液共热,都会有砖红色沉淀产生 |
下列有关化学用语的表达正确的是
A.甲醛的电子式: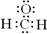 |
B.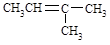 的名称:3―甲基―2―丁烯 的名称:3―甲基―2―丁烯 |
C.含78个中子的碘的放射性核素: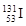 |
| D.纯碱溶液呈碱性的原理:CO32-+2H2O=H2CO3+2OH- |
中央电视台报道,一种名叫“排毒基强离子排毒仪”的产品正在市场热销。向排毒盆内倒入了纯净的温水,双脚放入盆中,启动电源开关,加入了适量精盐。过一段时间,盆中开始出现绿色、红褐色的絮状物。下列说法正确的是
| A.此“排毒基强离子排毒仪”一定是用惰性电极制成的 |
| B.加一些精盐的主要目的是起到消炎杀菌的作用 |
| C.绿色、红褐色的絮状物就是从脚底排出的体内毒素 |
| D.绿色、红褐色的絮状物是氢氧化亚铁、氢氧化铁形成的混合物 |
甲试管中盛有0.5mol/L Na2CO3溶液10mL,慢慢往试管中加入1mol/L的盐酸7.0mL;乙试管中盛有1mol/L的盐酸7.0mL,慢慢往试管中滴加0.5mol/L Na2CO3溶液10mL,那么甲、乙两试管中产生的CO2物质的量大小关系为()
| A.甲=乙 | B.甲>乙 | C.甲<乙 | D.无法确定 |
将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是()
| A.1:3 | B.2:5 | C.1:4 | D.2 :7 :7 |