NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:

已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
| |
Fe(OH)2 |
Fe(OH)3 |
Cr(OH)3 |
Ni(OH)2 |
| Ksp |
8.0×10—16 |
4.0×10—38 |
6.0×10—31 |
6.5×10—18 |
| 完全沉淀pH |
≥9.6 |
≥3.2 |
≥5.6 |
≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化学式)。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方为。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)。
(共6分)A、B、C是中学化学常见的三种有色物质,它们由Na、O、N、Cl等一种或两种元素组成,均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。请写出A、B、C分别与水反应的离子方程式。
⑴ A与H2O __________________________________。
⑵ B与H2O _______________ __________________。
⑶ C与H2O __________________________________。
黏土是很多硅酸盐产品的原料之一,创造历史、享誉全球的景德镇陶瓷就是利用了当地的优质黏土资源。请回答下列问题:
(1)黏土主要有效成分的化学式为Al2Si2O5(OH)4,若以氧化物形式表示,应写为____________。
(2)在黏土资源丰富的地区还可以兴建水泥厂、玻璃厂、硫酸厂等,这些工厂中属于硅酸盐工业的有__________________,玻璃厂生产雕花玻璃过程所依据的化学原理是
________________________________________(用化学方程式表示)。
(11分)已知: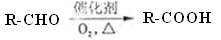
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。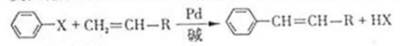
(X为卤原子,R为取代基)
经由Heck反应合成M(一种防晒剂)的路线如下: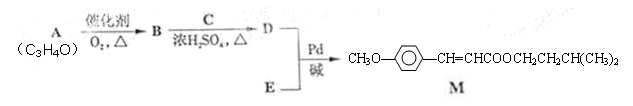
回答下列问题:
(1)M可发生的反应类型是______________。
a. 取代反应 b. 酯化反应 c. 消去反应 d. 加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是___ ____。
D在一定条件下反应生成高分子化合物G,G的结构简式是______ ____。
(3)在A→B的反应中,检验A是否反应完全的试剂是_____ __________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为_______。
(14分)Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,化合物D的焰色反应为黄色,C和G混合冒白烟并生成A,电解E的水溶液常用于某种工业生产。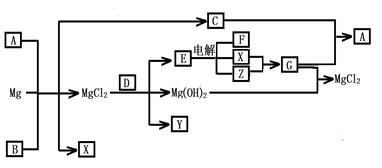
(1)写出下列物质的化学式
AY
(2)写出C的电子式
(3)写出A溶液中各离子浓度的大小顺序(由大到小)
(4)写出MgCl2与D反应的化学方程式
(5)写出电解E溶液的离子方程式
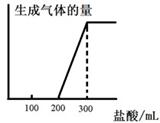
(6)将0.1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的关系如图所示:则原F溶液的浓度为mol/L。