设NA表示阿伏加德罗常数(约为6.02×1023mol-1 ),下列有关叙述不正确的是( )
 ①在标准状况下,VL水含有的氧原子个数为
①在标准状况下,VL水含有的氧原子个数为
 ②常温常压下,1mol碳烯(:CH2)所含电子总数为8NA
②常温常压下,1mol碳烯(:CH2)所含电子总数为8NA
 ③1L pH=1的水溶液中,水合氢离子数为0.1NA
③1L pH=1的水溶液中,水合氢离子数为0.1NA
 ④1molOH-在电解过程中被氧化,提供电子的数目为NA个
④1molOH-在电解过程中被氧化,提供电子的数目为NA个
 ⑤22.4L的HCl溶于水,溶液中H+数为NA
⑤22.4L的HCl溶于水,溶液中H+数为NA
 ⑥1 mol CO2与含2 mol NaOH的溶液反应后,溶液中CO32-数为NA
⑥1 mol CO2与含2 mol NaOH的溶液反应后,溶液中CO32-数为NA
 ⑦12g金刚石中所含共价键数目为NA
⑦12g金刚石中所含共价键数目为NA
 ⑧Na2O2与H2O反应,生成常温常压下16gO2,反应中转移电子数为NA
⑧Na2O2与H2O反应,生成常温常压下16gO2,反应中转移电子数为NA
 ⑨标准状况下,2.24L苯中约含有3.612 x 1023个碳原子
⑨标准状况下,2.24L苯中约含有3.612 x 1023个碳原子
 ⑩25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×l023个氢氧根离子
⑩25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×l023个氢氧根离子

| A.①②③④ | B.⑤⑥⑦⑧⑨ | C.①⑤⑥⑦⑨⑩ | D.③⑤⑥⑧⑨⑩ |
居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种刺激性气味的有机气体,它对人体极为有害。该气体是 ()
| A.甲烷 | B.甲醛 | C.氨气 | D.二氧化硫 |
第二十九届奥林匹克夏季运动会于2008年8月8日—24日在北京隆重举行并获得巨大成功。下图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃。下列说法正确的是()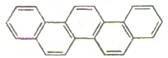
| A.该有机物的一氯代物只有一种 |
| B.该有机物是只含非极性键的非极性分子 |
| C.该有机物属于芳香族化合物,不是苯的同系物 |
| D.该有机物完全燃烧生成H2O的物质的量大于CO2的物质的量 |
在同温同压下,某有机物和过量Na反应得到V1 L 氢气,取另一份等量的有机物和足量NaHCO3反应得V2 L二氧化碳,若V1=V2≠0,则有 机物可能是 ()
A. |
B.HOOC—COOH | C.HOCH2CH2OH | D.CH3COOH |
若某有机物中一个碳原子以单键形式连有四个不同的原子或原子团时,该原子被称为手性碳原子。具有手性碳原子的物质常具有光学活性,如有机物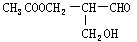 具有光学活性。该有机物发生下列反应后,不会失去光学活性的是: ( )
具有光学活性。该有机物发生下列反应后,不会失去光学活性的是: ( )
| A.与NaOH水溶液反应 | B.与银氨溶液反应 |
| C.与浓硫酸、乙酸共热 | D.与灼热的Cu、O2反应 |
将—CH3、—OH、—COOH、 四种原子团两两结合,所得化合物水溶液呈酸性的共( )
四种原子团两两结合,所得化合物水溶液呈酸性的共( )
| A.3种 | B.4种 | C.5种 | D.6种 |