分析下图所示装置,下列叙述不正确的是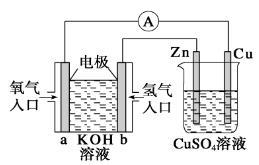
| A.左边装置是燃料电池,右边装置是电镀池 |
| B.电子流动方向:b→Zn→CuSO4(aq)→Cu→a |
| C.一段时间后,左端溶液浓度变小,右端溶液浓度不变 |
| D.当锌片的质量变化12.8g时,a极消耗标准状况下的O2 2.24 L |
实验室制下列各组气体,所用气体发生装置相同的是
| A.H2和CO2 | B.H2和O2 | C.Cl2和CO2 | D.Cl2和H2 |
将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量的关系如图所示则原溶液中Al3+、Mg2+、NH4+的物质的量分别为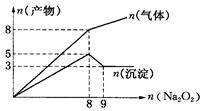
| A.2 mol、3 mol、8 mol |
| B.3 mol、2 mol、8 mol |
| C.2 mol、3 mol、4 mol |
| D.3 mol、2 mol、4 mol |
三氟化氮是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3NF3+5H2O=2NO+HNO3+9HF。下了有关该反应的说法正确的是:
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂与氧化剂的物质的量之比为2:1 |
| C.若生成0.2mol HNO3,则转移0.2mol电子 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
14g铜金合金与足量的某浓度HNO3反应,将产生的气体用1.12L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为
| A.9.6g | B.6.4g | C.3.2g | D.1.6g |
下列各组关系正确的是:
| A.原子半径 N<P<S | B.稳定性 NH3<H2O<HF |
| C.碱性 NaOH>KOH | D.酸性 H3AsO4>H2SeO4>HBrO4 |