将250mL含BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
| A.4(b-2a)mol/L | B.20(2a-b)mol/L |
| C.20(b-2a)mol/L | D.10(b-a)mol/L |
(改编题)下列能用勒夏特列原理解释的是()
①红棕色NO2加压后颜色先变深后变浅②实验室中常用排饱和食盐水的方式收集氯气③Fe(SCN)3溶液中加入固体KSCN后颜色变深④氯水宜保存在低温、避光条件下⑤合成氨反应,为提高氨的产率,理论上应采取降低温度的措施⑥ SO2催化氧化成SO3的反应,往往加入过量的空气⑦工业制取金属钾Na(l) + KCl(l)  NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
| A.①③⑤⑥⑦ | B.②④⑤⑥⑦ | C.①②④⑤⑥ | D.全部 |
(原创题)下列物质中,其水溶液能导电溶于水时化学键被破坏的非电解质是()
| A.盐酸 | B.硫酸钡 | C.乙醇 | D.二氧化硫 |
对于同温同压下可逆反应 2A(g) + B(s) 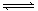 C(g)+D(g)达到平衡的标志是()
C(g)+D(g)达到平衡的标志是()
| A.压强不变 | B.每分钟A的减少量等于D的增加量的两倍 |
| C.B物质的浓度不变 | D.A物质的百分含量不变 |
1 g正丁烷(C4H10)燃烧生成CO2和液态水,放出49.6 kJ热量,则其热化学方程式为()
| A.2C4H10+13O2 ="=" 8CO2+10H2OΔH=-5 753.6 kJ·mol-1 |
| B.C4H10(g)+13/2 O2(g)==4CO2(g)+5H2O(g)ΔH=-2 876.8 kJ·mol-1 |
| C.2C4H10(g)+13O2(g)==8CO2(g)+10H2O(l)ΔH=-2 876.8 kJ·mol-1 |
| D.C4H10(g)+13/2 O2(g)==4CO2(g)+5H2O(l)ΔH=-2 876.8 kJ·mol-1 |
反应4A(g)+5B(g)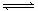 4C(g)+6D(g)在0.50 L密闭容器中进行,半分钟后,A减少了0.90 mol,则此反应的平均速率可以表示为()
4C(g)+6D(g)在0.50 L密闭容器中进行,半分钟后,A减少了0.90 mol,则此反应的平均速率可以表示为()
A. v(A)="3.6" mol·L-1·s-1 B. v(B)="0.075" mol·L-1·s-1
C. v(C)="0.030" mol·L-1·s-1 D. v(D)="0.060" mol·L-1·s-1