(1)下列各组物质:①金刚石和C60 ②H、D和T ③乙烷和已烷④CH3(CH2)2CH3和(CH3)2CHCH3中,互为同位素的是(填序号,下同)__ ___,互为同素异形体的是_ __,互为同系物的是_____,属于同分异构体的是__ ___。
(2)请写出2,3-二甲基丁烷的结构简式:
(3)请用系统命名法命名该烷烃CH3CH(C2H5)CH(CH3)2:
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.由徐光宪院士发起, 院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe2+的核外电子排布式。
(2)下列说法正确的是。
a.H2S、O3分子都是直线形
b.BF3和NH3都是含有极性键的非极性分子
c.CO2、HCN分子的结构式分别是:O=C=O、H—C≡N
d.CH3COOH分子中碳原子的杂化方式有:sp2、sp3
(3)NO是人体中的信号分子,有关说法正确的 。
a.原子半径N大于Ob.非金属性O大于N
c.NO+的结构式为:〔N≡O〕+ d.NO形成的晶体是分子晶体
(4)TiO2的天然晶体中,最稳定的一种晶体结构如图1,白球表示 原子。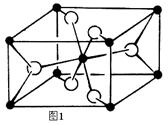
(5)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构:。
(6)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,实验室测定铁的含量:可用配位剂邻二氮菲
( ),它能与Fe2+形成红色配合物(如图2),该配离子中Fe2+与氮原子形成配位键共有个。
),它能与Fe2+形成红色配合物(如图2),该配离子中Fe2+与氮原子形成配位键共有个。
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l)△H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l)△H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的产率的是_________________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l)△H1
H2NCOONH4(氨基甲酸铵) (l)△H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示: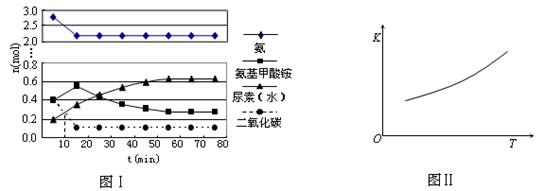
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定,总反应进行到min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H20(填“>”“<”或“=”)
(3)在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为 。
②已知:a :N2(g)+O2(g)= 2NO(g)△H=180.6 kJ·mol—1
b: N2(g)+3H2(g)= 2NH3(g)△H= —92.4kJ·mol—1
c:2H2(g)+O2(g)= 2H2O(g)△H= —483.6 kJ·mol—1
则4NO(g)+4NH3(g)+O2(g)= 4N2(g)+6H2O(g)△H=kJ·mol-1。
(4)尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为。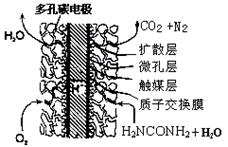
硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5·H2O来制取。
第①步:将硼镁矿用浓碱NaOH溶液溶解,过滤得NaBO2溶液。第②步:将NaBO2浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7·10H2O。
第③步:将硼砂溶于水后,用H2SO4调节酸度,过滤得H3BO3晶体。
第④步:加热硼酸使之脱水。
第⑤步:脱水产物用镁还原即得粗单质硼。请回答下列问题:
(1)第①步和第⑤步的化学方程式分别为,。
(2)将制得的粗硼在一定条件下反应全部生成BI3,然后BI3热分解可以得到纯净的单质硼。0.20g粗硼制成的BI3分解得到的I2全部被收集后,用 2.00mol/LNa2S2O3溶液滴定,用去27.00mL Na2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)。
①盛装Na2S2O3溶液的为(填“酸式”或“碱式”)滴定管。
滴定过程中所用的指示剂为,滴定终点的现象是
②粗硼中硼的含量为。
(3)上述制得的硼砂晶体(Na2B4O7·10H2O)还可制备过硼酸钠,它是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。巳知纯品过硼酸钠晶体中各元素的物质的量之比为n(Na):n(B):n(H):n(O)=l:1:n:7。将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如下图所示,则T3时所得晶体的化学式为:。若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2,则产品中钠的质量分数(填“升高”、“降低”或“不变”)。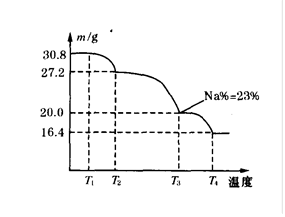
NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5% NO、1.5% NO2)用纯碱溶液完全吸收,得到NaNO2、NaNO3和Na2CO3的混合液及CO2气体。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到 NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0 t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1)第一步生产过程中发生反应的总化学方程式是 。
(2)检验NaNO3成品中是否含少量的Na2CO3杂质的方法是 。
(3)生产过程中Na2CO3的利用率是 (计算结果精确到小数点后两位)。
(4)生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积至少为 m3
(标准状况下)。
下图是一种治疗关节炎止痛药(F)的传统合成法路线图:
请回答下列问题:
(1)A→B的化学方程式为。
(2)C分子中手性碳原子数目为;D→E的反应类型。
(3)E在酸性条件下发生水解反应生成F和无机盐,该无机盐中的阳离子为。
(4)比F少5个碳原子的同系物X有多种同分异构体,其中满足下列条件的X的同分异构体结构简式为(写出任意一种)。
①属于芳香族化合物,②苯环上只有1个取代基,③属于酯类物质
(5)改良法合成该关节炎止痛药(F)是以2-甲基-1-丙醇、苯为原料合成的,产率和原子利用率都比较高。试写出改良法合成该关节炎止痛药(F)的合成路线图(乙酸酐和其他无机试剂任选)。合成路线流程图示例如下:
CH3CH2OH CH2=CH2
CH2=CH2 Br-CH2CH2-Br
Br-CH2CH2-Br
已知:①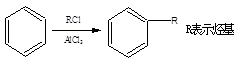
②