氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。
Ⅰ.实验室模拟工业氨催化氧化法制取硝酸,装置如下图所示。
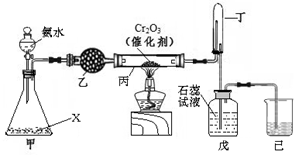
(1)若分液漏斗中氨水的浓度为9.0mol·L-1,配制该浓度的氨水100mL,用到的玻璃仪器有烧杯、玻璃棒、量筒、 、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的化学式为 。
(3)写出受热时丙装置发生反应的化学方程式 。当戊中观察到石蕊试液变红,则说明已制得硝酸。
Ⅱ.NH3的性质
(4)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),将等浓度、等体积的氨水和硝酸混合,所得溶液中离子浓度从大到小的顺序为 。
(5)已知:氨在纯氧中燃烧生成一种单质和水,利用此原理设计成氨气-氧气燃料电池。在碱性条件下,该电池的负极反应式为 。
为测定一种气态烃A的分子式,取一定量的A置于密闭容器中燃烧,定性实验表明产物是CO2、CO、水蒸气。学生甲、乙设计了如下两个方案,均认为根据自己的方案能求出A的实验式。他们测得的有关数据如下(图中的箭头表示气体的流向,实验前系统内的空气已排除),试完成下列问题: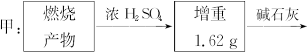
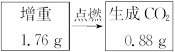
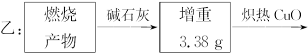

(1)两种方案能否都可求出A的实验式(即C、H原子个数比)?
(2)若能求,通过计算求出A的实验式。
(3)若要确定A的分子式,是否还需要测定其他数据?如果需要,该测定哪些数据?
如下图,某气体X可能由H2、CO、CH4中的一种或几种组成,将X气体点燃,把燃烧后生成的气体通过A、B两个洗气瓶。试完成下列问题: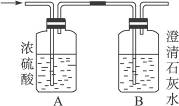
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是___________。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是___________。
(3)若A和B两个洗气瓶的质量都增加,则气体X可能是______________________。
下图是德国化学家李比希1831年测定烃类化合物(只含C、H两种元素)组成的装置。瓷盘内的烃样品经加热分解或气化后用纯O2气流驱赶经过灼热的CuO,这里烃类化合物反应变成CO2和H2O,再经吸收管吸收。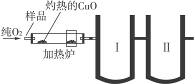
已知下列数据:
| 瓷盘 |
吸收管Ⅰ |
吸收管Ⅱ |
|||
| 瓷舟 |
样品+瓷舟 |
吸收前 |
吸收后 |
吸收前 |
吸收后 |
| A mg |
B mg |
C mg |
D mg |
E mg |
F mg |
(1)烃样品在反应过程中所用的氧化剂是________________________。
(2)吸收管Ⅰ应装的吸收剂是________,吸收管Ⅱ应装的吸收剂是________。
(3)样品中碳的质量分数的数学表达式是____________________。
(4)样品中氢的质量分数的数学表达式是____________________。
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有: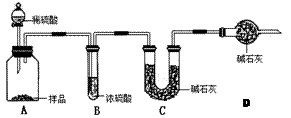
NH3+CO2+H2O → NH4HCO3,NH4HCO3+NaCl(饱和)→ NaHCO3↓+NH4Cl,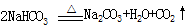 。请回答:
。请回答:
(1)工业制得的纯碱中常常含有少量的氯化钠杂质,其主要原因是。
(2)现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计如下方案,请你帮助他们完成如下实验。
甲:用(填实验仪器)称取10.0g样品,利用上图所示装置,测出反应后装置C中碱石灰增重3.52g。装置D中碱石灰的作用是。
乙:准确称取10.00g样品后,用(填实验仪器)配成1000mL溶液,用
式滴定管量取25.00mL放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+HCl → NaCl+NaHCO3)。完成三次平行实验后,消耗盐酸体积的平均值为15.00mL。
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得到固体物质于干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
| 分析与计算 分组 |
计算样品中碳酸钠的质量分数 |
实验结果的评价 |
实验失败的主要原因及对结果的影响 |
| 甲 |
失败 |
||
| 乙 |
 成功 成功 |
||
| 丙 |
 成功 成功 |
(1)可以验证镁、铝的金属性强弱的实验是___________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(2)现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。