常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)="0.1" mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
相对分子质量为100的烃完全燃烧后,生成CO2和H2O的物质的量之比以及分子结构中有四个甲基的同分异构体的数目分别是
| A.6:7和2 | B.6:7和3 | C.7:8和3 | D.7:8和4 |
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g)ΔH=+67.7kJ/mol,
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,
下列说法正确的是
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5++ OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
下列说法或表述正确的是
A由水电离产生的c(H+)=1×10-2mol•L-1溶液中,可能存在:CO32-、NH4+、Cl-、Na+
B某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
C Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为:3Ba2++6OH- +2Al3+ +3SO42-=3BaSO4↓+2Al(OH)3↓
D物质的量浓度均为1 mol•L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值)
用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论叙述正确的是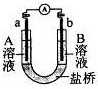
| 选项 |
电极a |
电极b |
A溶液 |
B溶液 |
现象或结论 |
| A |
Cu |
Zn |
CuSO4 |
ZnSO4 |
一段时间后,a增加的质量与b减少的质量相等 |
| B |
Cu |
Zn |
稀H2SO4 |
ZnSO4 |
盐桥中阳离子向b极移动 |
| C |
C |
C |
FeCl3 |
KI、淀粉混 合液 |
b极附近溶液变蓝 |
| D |
Fe |
C |
NaCl |
FeCl3 |
外电路电子转移方向:b→a |
下列分类正确的是
| A.共价化合物:硫酸、水、纯碱 |
| B.非电解质:乙醇、二氧化碳、氨气 |
| C.胶体:饱和氯化铁溶液、豆浆、牛奶 |
| D.硅酸盐产品:水晶、玻璃、陶瓷 |