高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+Cu2S+H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
② MnO4-+CuS +H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是 (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++ H2O
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。需要的玻璃仪器有
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(4)用软锰矿制备K2MnO4的化学方程式是: 。
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。
[物质结构与性质]
铁是最常见的金属材料。铁能形成 [Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物。
(1)基态Fe3+的M层电子排布式为 ;
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(4)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为 ,如果铁的原子半径为a cm,阿伏加德常数的值为NA,则此种铁单质的密度表达式为 g/cm3。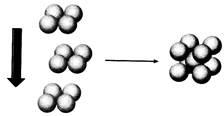
[化学与技术]
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。该厂拟定如图所示的废水处理流程。
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是_________________________________
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因_____________________。
(3)②中反应后无气体放出,该反应的离子方程式为____________________________。
(4)③中反应时,每0.4 mol Cr2O72-转移2.4 mol的电子,该反应的离子方程式为______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因。
二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ.某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g) 2ClNO(g) △H1< 0其平衡常数为K1
2ClNO(g) △H1< 0其平衡常数为K1
ii.2NO2(g)+NaCl(s)  NaNO3(s)+ClNO(g) △H2<0其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO) = ,平衡常数K2= ;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:
α1(NO2) = α2(NO2)(填“>”“<”或“=”)。
II.除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是 。
| A.c(Na+) = c(HSO3-)+ 2c(SO32-) |
| B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—) |
| C.2c(Na+) =2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
| D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3) |
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如下图所示,则
①工作一段时间后,阴极区溶液的pH (填“增大”“减小”或“不变”);
②写出阳极的电极反应式 。
过氧化尿素是一种新型漂白、消毒剂,漂白、消毒效果优于H2O2和过氧乙酸,某工业用过氧化尿素的部分参数列于下表。
| 分子式 |
外观 |
热分解温度 |
熔点 |
水溶性(20℃) |
| CO(NH2)2·H2O2 |
白色晶体 |
45℃ |
75—85℃ |
500g·L—1 |
合成过氧化尿素的流程及反应器的示意图如下: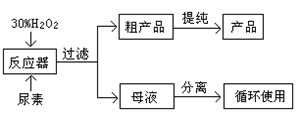
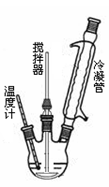
请回答下列问题:
(1)写出合成过氧化尿素的化学方程式 。
(2)反应器里冷凝管中冷水从 (填“上”或“下”)口流入;反应器的加热方式是 ________ 。
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是 。
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是 。
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:完成并配平下列化学方程式:
MnO4—+ H2O2+ H+= Mn2++ H2O+ 
②KMnO4溶液应盛放在 滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 (填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量 (填“合格”或“不合格”),活性氧的质量分数为 。
工业上制取硝酸铵的流程图如下,请回答下列问题: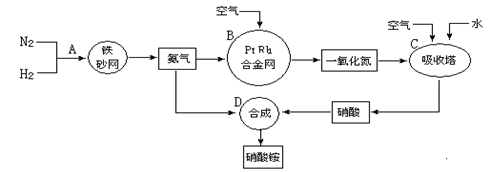
(1)在上述工业制硝酸的生产中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
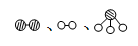 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
| 注意事项 |
理由 |
|
| ① |
||
| ② |