下列选项中有关离子方程式的书写正确的是
| A.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| B.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C.过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O=HCO3-+HClO |
| D.硫化钠水溶液呈碱性的原因:S2-+2H2O=H2S+2OH- |
不能用于判断HA是弱电解质(弱酸)的依据是
A.浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多。
B.pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多。
C.浓度相等的HCl与HA两溶液,C(HCl中H+)约是C(HA中H+)的100倍。
D.pH相等的HCl与HA两溶液,C(HA)约是C(HCl)的100倍。
在一定温度下,向一个容积可变的恒压容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
| A.第一次实验平衡时反应放出的热量为98.3kJ |
B.第一次实 验平衡时SO2的转化率比第二次实验平衡时SO2的转化率大 验平衡时SO2的转化率比第二次实验平衡时SO2的转化率大 |
| C.第二次实验达平衡时SO3的体积分数大于2/9 |
| D.两次实验平衡时,SO3的浓度不相等 |
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
| A.c(H+) | B.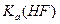 |
C.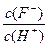 |
D. |
已知同温同浓度时① H2CO3比H2S电离度大,②H2S比HCO3-电离度大,则下列反应不正确的是
H2CO3比H2S电离度大,②H2S比HCO3-电离度大,则下列反应不正确的是
| A.Na2CO3+H2S==NaHCO3+NaHS | B.Na2S+H2O+CO2==NaHS+NaHCO3 |
| C.2NaHCO3+H2S==Na2S+2H2O+2CO2 | D.NaHS+H2O+CO2==NaHCO3+H2S |
在给定的四种溶液中加入以下各种离子,各离子能在原溶液中大量共存的是
| A.滴加甲基橙试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- |
| B.pH值为1的溶液 Cu2+、Na+、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ |
| D.所含溶质为Na2SO4的溶液 K+、HCO3-、NO3-、Al3+ |