将4 mol金属Al全部转化为Al(OH)3,过程中共消耗HCl a mol、NaOH b mol,则a+b最小值为
| A.4 | B.6 | C.8 | D.16 |
如图所示,下列叙述正确的是()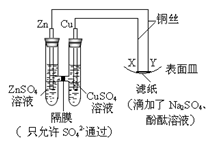
| A. | 为阴极,发生还原反应 | B. | 为正极,发生氧化反应 |
| C. | 与滤纸接触处有氧气生成 | D. | 与滤纸接触处变红 |
把aL含硫酸铵和硝酸铵的混合液分成2等份,一份需用bmol烧碱刚好把氨气全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中NO3-离子的物质量浓度为(单位:mol·L-1)
| A.(b-2c)/a | B.(2b-2c)/a | C.(2b-c)/a | D.(2b-4c)/a |
“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是
| A.制CuSO4:Cu + 2H2SO4(浓)= CuSO4 + SO2↑+ 2H2O |
| B.制CuSO4:2Cu + O2= 2CuO; CuO + H2SO4(稀) = CuSO4 + H2O |
| C.制Cu(NO3)2:Cu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+ 2H2O |
| D.制Cu(NO3)2:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O |
.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径:A>B>D>C | B.原子序数:d>c>b>a |
| C.离子半径:C3->D->B+>A2+ | D.单质还原性:A>B>D>C |
下列分子中所有原子未全部满足最外层为8个电子结构的是
| A.CCl4 | B.CO2 | C.HCl | D.PCl3 |