下列说法中,正确的是
| A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应 |
| C.生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0 |
| D.ΔH的大小与热化学方程式的化学计量数无关 |
乙烯雌酚(M)的结构简式如图,它是一种激素类药物,有关叙述中不正确的是( )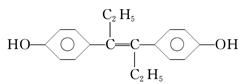
| A.M的分子式为C18H20O2 |
| B.M与NaOH溶液或NaHCO3溶液均能反应 |
| C.1 mol M最多能与7 mol H2发生加成反应 |
| D.1 mol M与饱和溴水混合,最多消耗 5 mol Br2 |
“今年过节不收礼,收礼还收脑白金”,反应了中国人收礼的习俗,脑白金中有效成分的结构简式如图,下列对该化合物的叙述正确的是()
A它属于芳香烃,含有碳碳双键和肽键,能使高锰酸钾溶液和溴水褪色,但原理不同
B它属于高分子化合物,所有原子不可能共面
C分子式C13N2H16O2,能和盐酸发生化学反应,体现了一定的碱性
D在一定条件下可以发生加成反应、氧化反应、水解反应,酯化反应
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡有手性碳原子的物质一定具有光学属性。如图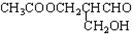 ,该有机物发生下列反应后的生成物还有光学活性的是()
,该有机物发生下列反应后的生成物还有光学活性的是()
| A.与乙酸发生酯化反应 | B.与NaOH 水溶液共热 |
| C.与银氨溶液作用 | D.在催化剂存在下与氢气反应 |
下列有机物命名正确的是()
A.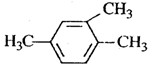 1,3,4-三甲苯 1,3,4-三甲苯 |
B.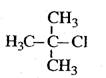 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 |
C.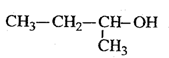 2-甲基-1-丙醇 2-甲基-1-丙醇 |
D.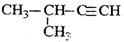 2-甲基-3-丁炔 2-甲基-3-丁炔 |
NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下: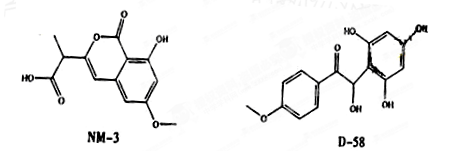
关于NM-3和D-58的叙述,错误的是()
| A.遇FeCl3溶液都显色,原因相同 | B.都不能发生消去反应,原因相同 |
| C.都能与溴水反应,原因不完全相同 | D.都能与NaOH溶液反应,原因不完全相同 |