有一白色粉末,可能由NaOH、K2SO4、CuSO4、Ba(OH)2、CaCO3、BaCl2中的一种或几种组成,进行下列实验:
(1)向粉末中加入足量水,充分溶解后过滤,得白色沉淀和无色滤液,该沉淀可能是______________,原粉末一定不含____________。
(2)向⑴中沉淀加入足量盐酸,沉淀部分溶解,产生无色气体。原粉末一定含有____________,反应的离子方程式为___________________。
(3)取⑴中的滤液,通入少量⑵中产生的气体,又产生白色沉淀,过滤得滤液。则⑴中的滤液一定含有_________________离子。
(4) 取⑶中得到的滤液加入AgNO3溶液和稀硝酸,又产生白色沉淀,离子反应方程式为________________。原粉末中一定含有______________,至少含有____________________中的一种。
有机物A的分子式为C9H10O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):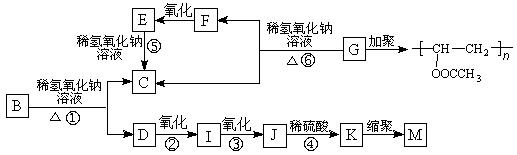
其中K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构。
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH→RCH2CHO;
②-ONa连在烃基上不会被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,该官能团的名称是 。
(2)上述变化中属于水解反应的是 (填反应编号)。
(3)写出结构简式,G: ,M: 。
(4)写出反应①的化学方程式: 。
(5)任写一种符合下列要求的A的同分异构体 。
I.含有苯环 II.能发生银镜反应,且能使氯化铁溶液显紫色
III.苯环上的一元取代物只有一种
已知A是生产某新型工程塑料的基础原料之一,合成A的路线如下图所示。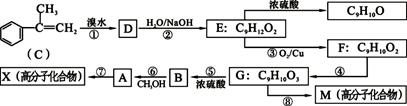
(1)与C分子式相同的一种物质化学名称叫:4-甲基苯乙烯,写出其结构简式_____。
(2)反应⑦为加聚反应,⑤的反应类型为______,写出A的结构简式为______,F的含氧官能团名称______。
(3)写出反应⑧的化学方程式______。
(4)A有多种同分异构体,符合下列条件的同分异构体有____种。
①分子中有6个碳原子在一条直线上②苯环上的一硝基取代物只有1种
③分子的核磁共振氢谱有4个吸收峰
写出其中一种与碳酸钠溶液反应的化学方程式:______。
芳香烃X是一种重要的有机化工原料,其摩尔质量为92g·mol一1,某课题小组以它为原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。已知A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
已知: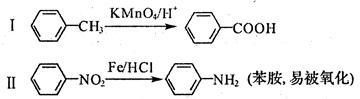
回答下列问题:
(1)对于阿司匹林,下列说法正确的是_______
| A.是乙酸的同系物 |
| B.能发生酯化反应 |
| C.1 mol阿司匹林最多能消耗2mol NaOH |
| D.不能发生加成反应 |
(2)H的结构简式是_________,F→G的反应类型是_______。
(3)写出C→D的化学方程式_______。
( 4)写出符合下列条件的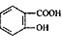 的同分异构体的结构简式_______。(写出2种)
的同分异构体的结构简式_______。(写出2种)
①属于芳香族化合物,且能发生银镜反应;
②核磁共振氢谱图中峰面积之比为1 :2:2:1
③分子中有2个羟基
(5)以A为原料可合成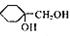 ,请设计合成路线,要求不超过4步(无机试剂任选)。
,请设计合成路线,要求不超过4步(无机试剂任选)。
注:合成路线的书写格式参照如下示例流程图:
可降解聚合物G可由芳香烃A通过如下途径制备,质谱法测定A相对分子质量为102。
已知①B为高分子化合物,D的化学式为C8H10O2
②
③碳碳双键的碳上连有羟基的有机物不稳定
(1)对于高分子G的说法不正确的是()
A.1mol G最多能与2n mol NaOH反应
B.一定条件下能发生取代与加成反应
C.碱性条件下充分降解,F为其中一种产物
D.(C9H8O3)n既是高分子G的化学式也是其链节的化学式
(2)A、X的化学式分别为________________ ,
(3)写出C→D的化学方程式 。
(4)写出B的结构简式
(5)同时符合下列条件F的稳定同分异构 体共 种,写出其中一种结构简式
①遇FeCl3不显紫色,除苯环外不含其它环状结构;
②苯环上有三种不同化学环境的氢原子;
③不能发生银镜反应。
(6)以苯和乙烯为原料可合成D,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下实例流程图:
CH3CHO  CH3COOH
CH3COOH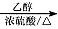 CH3COOCH2CH3
CH3COOCH2CH3
药物普仑司特对预防和治疗中耳炎、银屑病等均有良好疗效。在普仑司特的合成中需要用到关键中间体M(1﹣溴﹣4﹣苯丁烷)。中间体M的合成路线如下:
已知:
回答下列问题:
(1)D中的官能团为 :反应④属于 反应(填反应类型);
B的结构简式为 。
(2)写出一种满足下列条件的A的同分异构体的结构简式: 。
A.能发生银镜反应和水解反应: B.不存在顺反异构体
(3)利用溴代烃E (含溴质量分数为66.1%)为起始原料也可制得中间体M:
则E的结构简式为
F→M的化学方程式为 。
(4)C6H5MgBr与化合物G在一定条件下直接反应可制得M。①用系统命名法给化合物G命名: ;②写出加热条件下G在足量NaOH醇溶液中反应的化学方程式: 。