(1)相同物质的量的O2和O3的质量比________,分子个数比为________,所含氧原子的个数比为________。
(2)在200 mL 2 mol·L-1MgCl2溶液中,溶质的质量为______。此溶液中Mg2+的物质的量浓度为________,Cl-的物质的量浓度为___________________。
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。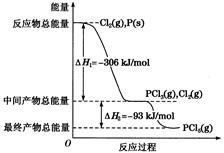
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是_______________________
(2)PCl5分解成PCl3和Cl2的热化学方程式是_______________________
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________,P和Cl2一步反应生成1 mol PCl5的ΔH4_____________ΔH3(填“大于”、“小于”或“等于”)。
(1)CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
| 化学键 |
C-H |
C=C |
C-C |
H-H |
| 键能(kJ/mol) |
414.4 |
615.3 |
347.4 |
435.3 |
计算该反应的反应热 (写出计算过程)
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)△H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g)ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ/mol
试计算1 mol肼和二氧化氮完全反应时放出的热量为__________________kJ,写出肼与二氧化氮反应的热化学方程式:______________________
如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题: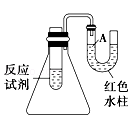
(1)将铝片加入小试管内,然后注入足量稀盐酸,有关反应的离子方程式是 ,试管中观察到的现象是
(2)U形导管中液面A (填“上升”或“下降”),原因是 ,说明此反应是 (填“吸热”或“放热”)反应。
将一定量的A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s)  2C(g)。忽略固体的体积,平衡时A的体积分数(%)随温度和压强的变化如下表所示:
2C(g)。忽略固体的体积,平衡时A的体积分数(%)随温度和压强的变化如下表所示:
 压强/MPa 压强/MPa 体积分数/% 体积分数/%温度/℃ |
1.0 |
2.0 |
3.0 |
| 810 |
46.0 |
a |
b |
| 915 |
c |
25.0 |
d |
| 1000 |
e |
f |
15.0 |
回答下列问题:
(1)欲提高C的产率,应采取的措施为 ;
(2)该反应△H 0(填“<”或“>”);
(3)比较K(810℃) K(915℃) (填“<”、“>”或“=”),说明理由 ;
(4)915℃ 2.0MP时A的转化率为 ;
(5)比较b f(填“<”、“>”或“=”),说明理由 ;
(6)若1000℃,3.0MPa时,向容器中加入0.16mol A和0.20mol B,平衡时容器体积为10L,则此时平衡常数K= (保留两位有效数字)。
自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题。
(1).已知N2(g)+O2(g)=2NO(g) ΔH=+180.5KJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH= -566.0 KJ·mol-1
则加催化剂处理汽车尾气的热化学方程是
(2).反应2NO2(g) 2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
| 时间(s) |
0 |
10 |
20 |
25 |
30 |
| 条件A [n(NO2)](mol) |
0.20 |
0.14 |
0.13 |
0.13 |
0.13 |
| 条件B [n(NO2)](mol) |
0.20 |
0.10 |
0.10 |
0.10 |
0.10 |
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是
A.有、无催化剂B.温度不同 C.压强不同D.容器体积不同
②能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为 mol·L-1·s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应 (填“正向”、“逆向”或“不移动”)。