(1)写离子方程式a.氯化铝溶液中加入过量氨水的离子方程式为_______________;b.碳酸钙与盐酸反应的离子方程式为______________
(2)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,发生反应的离子方程式为_______________;在上述溶液中,继续滴加Ba(OH)2溶液,此步反应的离子方程式为_______________________。
(3)一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。
如 的拆写
的拆写
结果是:氧化反应为: ;
;
还原反应为: 。
。
①请据此将反应:
拆写成两个“半反应式”:氧化反应为__________________;还原反应为__________________。
我国拥有很长的海岸线,具有丰富的海洋资源,以海水为原料的盐化工是我国重要的产业。盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如下图甲)。盐卤在食品、化工等方面具有广泛的用途。请解答下列与盐卤有关的试题。
(1)根据图甲,写出盐卤中含量最多的两种盐的化学式:、。
(2)下图乙是盐卤中某些物质的溶解度曲线,已知T1℃时,MgSO4和KCl的溶解度分别为M、N,则它们溶解度大小的关系为;将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是。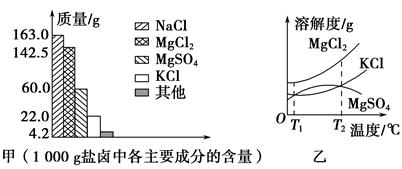
(3)化工厂利用卤水生产金属镁的工艺流程如下:
“操作①”的目的是将氢氧化镁沉淀分离出来,操作①的名称是。氢氧化镁与试剂B反应的化学方程式为。
操作②的名称是。该方法的优点为。
(4)用电解法制备金属镁,两位同学分别设计了下面的两种方法。
甲:电解氯化镁溶液。
乙:电解熔融的氯化镁。
其中同学(填“甲”或“乙”)能够成功地制备金属镁,假设生产过程中镁元素没有损失,则100 g卤水可制备镁g。
某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题: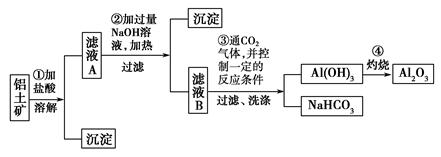
(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是。
在灼烧操作中用到下列仪器中的一种,其名称是。
(2)写出步骤①中发生反应的离子方程式。
(3)操作③中的洗涤操作如何进行?。
(4)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。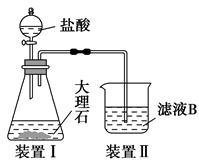
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?。若合理,请用离子方程式解释其原因(若你认为不合理,该空不作答)。
丙同学分析认为:甲同学通入的CO2中含有HCl气体,也是导致实验失败的原因,在实验中增加某装置可解决这个问题。请帮助丙同学画出该装置图,并注明试剂名称。
某化学小组的同学到实验室学习。在实验桌上摆有如图所示仪器:
(1)指导教师要求同学们写出仪器的名称,某同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则此空不需要填写)。
| 仪器编号 |
a |
b |
c |
d |
e |
| 名称 |
试管 |
溶量瓶 |
集气瓶 |
碱式滴定管 |
普通漏斗 |
| 改正的名称 |
(2)甲同学想用d进行实验,请你说出该仪器(已经洗涤干净)使用时的第一步操作:。
(3)关于e的用途,乙同学说可组成防倒吸装置。你还能说出其他两种用途吗?
①;
②。
(4)丙同学想用如图所示装置用大理石和稀盐酸反应制取CO2。老师指出,这需要太多的稀盐酸,会造成浪费,该同学选用了上面的一种仪器,加在装置中,解决了这个问题。请你把该仪器画在图中合适的位置。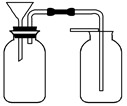
根据图示及描述,回答下列问题: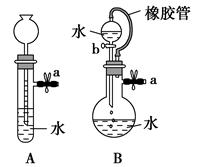
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管口注入一定量的水,静置后如图所示。试判断:A装置是否漏气?(填“漏气”、“不漏气”或“无法确定”),判断理由。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?(填“漏气”、“不漏气”或“无法确定”),判断理由。
【物质结构与性质】金属元素在自然界中分布很广,其中铜等在生产生活中有着广泛的应用。
(1)科学家通过X射线推测胆矾结构示意图如下所示,
①写出基态Cu原子的核外电子排布式 ;金属铜采用下列 (填字母代号)堆积方式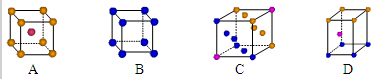
②胆矾中含有的微粒间作用力有 (填字母代号)。
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
③铜离子形成胆矾中配离子的离子方程式为: ;
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-表示CH3COO-),其反应是:
[Cu(NH3)2] Ac +CO+NH3[Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)] △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为 。
② 氨分子中N原子的杂化方式为 。
(3)铜的化合物种类也很多,其常见价态为+1、+2价。如CuO、Cu2O、CuH等。右图是铜的一种氯化物晶体的晶胞结构,则它的化学式是 。