建设资源节约型、环境友好型社会是政府的工作目标,以下措施中不能体现这一思想
的是
| A.在电解铝工业中添加冰晶石 |
| B.开发太阳能、风能、氢能等清洁能源 |
| C.收集废弃的秸杆等生产沼气 |
| D.为防止电池中的重金属污染土壤,将废旧电池深埋地下 |
下列说法正确的是
| A.二氧化硫具有漂白性,所以可以使溴水褪色 |
| B.硫在少量氧气中燃烧生成二氧化硫,在过量氧气中燃烧生成三氧化硫 |
| C.雷雨天氮元素可以进行下列转化:N2→NO→NO2→HNO3 |
| D.氮气的化学性质非常稳定,不支持任何物质的燃烧 |
下列说法错误的是
| A.氮的氧化物是汽车尾气中的主要污染物之一 |
| B.氮的氧化物既可形成酸雨,又是光化学污染的主要成分 |
| C.化石燃料的燃烧是造成空气中二氧化硫含量增多的主要因素 |
| D.酸雨在空气中静置一段时间后,雨水的酸性会慢慢减弱 |
下列说法正确的是(NA表示阿伏加德罗常数)
| A.1mol钠和足量水反应可生成11.2L氢气 |
| B.常温常压下,32g氧气中含有2NA个氧分子 |
| C.1mol/LK2SO4溶液中,含有2mol钾离子 |
| D.标准状况下,22.4LHCl溶于水后溶液中含有NA个氢离子 |
下列说法正确的是
| A.氨气是非电解质,氨水是电解质 |
| B.氢氧化铁胶体可以发生丁达尔现象 |
| C.摩尔和物质的量均是联系宏观和微观数量的物理量 |
| D.二氧化硅既可和酸又可和碱反应,所以二氧化硅是两性氧化物 |
要熟练掌握有机化学基础知识。按要求回答下列问题
(1)测得某烃与乙烯的混合气体的平均相对分子质量为20,则该烃为_______。
(2)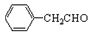 的不饱和度为____________。
的不饱和度为____________。
(3)相同质量的乙烷、乙烯、乙炔完全燃烧,消耗氧气物质的量最多的物质是_____。
(4)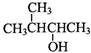 的系统命名为__________________。
的系统命名为__________________。