工业上用铝土矿(主要成分为Al2O3,含Fe2O3 杂质)为原料冶炼铝的工艺流程如下图所示,
下列叙述正确的是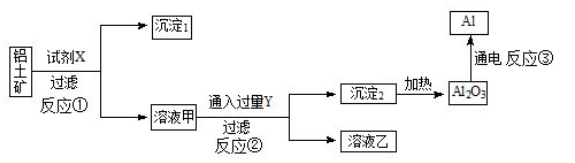
| A.试剂X 可以是氢氧化钠溶液,也可以是稀硫酸 |
| B.反应③中铝在阳极生成 |
| C.图中所示转化反应都是非氧化还原反应 |
D.反应②的化学方程式为: |
下列离子方程式正确的是
| A.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I- = 2Fe2+ + I2 |
| B.氧化铝溶解在NaOH溶液中: Al2O3 + 2OH-=2AlO2-+H2O |
| C.硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全 Al3+ + SO42-+ Ba2+ + 3OH- = BaSO4 ↓ + Al(OH)3↓ |
| D.在漂白粉配制成的溶液中通入SO2:Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓+ 2HClO |
设NA为阿伏伽德罗常数的值。下列说正确的是
| A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| B.室温下,1L pH=13的NaOH溶液中,由水电离的OH- 离子数目为0.1NA |
| C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
| D.5NH4NO3= 2HNO3+ 4N2↑ + 9H2O反应中,生成28g N2时,转移的电子数目为3.75NA |
下列物质与其用途完全符合的有几条
①Na2CO3-制玻璃②SiO2-太阳能电池③AgI-人工降雨
④NaCl-制纯碱⑤Al2O3-焊接钢轨⑥NaClO-消毒剂
⑦MgO-耐火材料⑧Fe2O3-红色油漆或涂料
| A.4 | B.5 | C.6 | D.7 |
下列物质间转化都能通过一步实现的是
| A.Si→SiO2→H2SiO3→Na2SiO3 |
| B.Al→Al2O3→NaAlO2→Al(OH)3 |
| C.S→SO3→H2SO4→SO2 |
| D.N2→NO2→HNO3→NO |
制造硫酸的工艺流程反应其中之一是2SO2(g)+O2(g)←→2SO3(g)+190 kJ。下列描述中能说明上述反应已达平衡的是
| A.v(O2)正=2v(SO3) |
| B.容器中气体的平均摩尔质量不随时间而变化 |
| C.如果容器容积是固定的,那么混合气体的密度不随时间而变化 |
| D.单位时间内生成n mol SO3的同时生成n mol O2 |